5.1. структура и функции иммунной системы
5.1. структура и функции иммунной системы
1) Неспецифический иммунный ответ. Механическая защита. Нормальная кожа и всевозможные эпителиальные покровы слизистых оболочек образуют первый, простой и весьма эффективный барьер на пути инвазии патогенных возбудителей. В большинстве случаев в слизистых оболочках используются механизмы, облегчающие изгнание таких возбудителей. К ним относятся движение стенок органов, выстланных эпителием, например при кашле, чиханье и рвоте, а также постоянное движение слизи в дыхательных путях в проксимальном направлении, обеспечиваемое работой ресничек респираторного эпителия (см. главу 15). Сходная функция осуществляется в кишечнике с помощью перистальтики. Наконец, ток стерильной мочи способствует очищению мочевых путей, а ток слезной жидкости — очищению глаз.
Гуморальные механизмы. Жидкости, вырабатываемые большинством тканей организма, содержат факторы, способные убивать или тормозить рост патогенных возбудителей. Так, пот, выделяемый потовыми железами кожи, обладает противомикробными свойствами, а кровь, слезная жидкость, тюна и секреторные продукты кишечника богаты ферментом ли-зоцимом, полиаминами и прочими антибактериальными субстратами (см. главу 14). Ряд защитных белков, имеющихся в крови и других жидких средах организма, содержит компоненты комплемента, С-реактивный белок и интерфероны. Кроме того, в состав кишечных секреторных продуктов входят такие факторы, обладающие неспецифическими иммунными свойствами, как желудочный сок, панкреатические ферменты и соли желчных кислот. Их наличие делает местную окружающую среду для возбудителей, попавших в кишечник, неприемлемой. Понятно, что у многих возбудителей выработаны механизмы преодоления защитных барьеров.
Клеточные механизмы. Множество типов клеток участвует в механизмах неспецифического иммунитета: все полиморфно-ядерные лейкоциты (нейтрофильные, базофиль-ные и эозинофильные), мононуклеарные фагоциты, тучные клетки и естественные киллеры (natural killer, NK). Хорошо известно, насколько широко в тканях организма распространены клетки системы мононуклеарных фагоцитов. В зависимости от органной принадлежности они имеют разные обозначения: в соединительной ткани и лимфоидной системе — гистиоциты, в печени — купферовские клетки (K.W.Kupffer), в легких — альвеолярные макрофаги, в головном мозге — клетки микроглии, в почечных клубочках — мезангиоциты, в других тканях — макрофаги. Лейкоциты и макрофаги способны поглощать и уничтожать возбудителей (см. главу 2). NK-клетки составляют субпопуляцию лимфоцитов. С помощью неспецифических механизмов они способны уничтожать клетки организма хозяина, инфицированные каким-либо возбудителем. Все перечисленные механизмы действуют быстро и на ранних этапах инфекции. Иногда они функционируют в отсутствие специфического иммунного ответа. Но многие из них бывают инициированы или усилены компонентами специфической иммунной системы.
2) Специфический иммунный ответ. Признаками такого ответа, отличающими его от неспецифических иммунных реакций, являются специфичность, иммунологическая память, распознавание «своего» и «чужого».
Специфичность проявляется в том, что инфекция, вызванная каким-либо возбудителем, приводит к развитию защиты только против этого возбудителя или близкородственного агента.
Память возникает после реализации иммунного ответа на какой-либо конкретный возбудитель и, как правило, сохраняется в течение всей последующей жизни в качестве защиты от повторной инфекции, вызываемой этим же возбудителем (по R.N.M.MacSween, K.Whaley, 1994). Такой механизм обеспечивается способностью иммунной системы к быстрому воскрешению в памяти биохимического состава некоторых субстанций патогенного возбудителя. Механизм иммунологической памяти обусловливает ускоренный и сильный ответ (вторичный иммунный ответ) при повторной инфекции. Он является основой развития иммунизации, т.е. естественной или искусственно созданной иммунологической защиты против такой инфекции.
Различение «своего» и «чужого» — важный механизм специфического иммунного ответа, выражающийся в распознавании компонентов собственных тканей организма и чужеродных продуктов. Изредка организм принимает указанные компоненты за чужеродные и осуществляет аутоиммунный ответ. Однако следует иметь в виду, что период контактов с компонентами собственных тканей в ходе внутриутробного развития плода является вполне достаточным для возникновения состояния стабильной специфической невосприимчивости к своим тканям. Указанное состояние называют иммунологической толерантностью. Специфические иммунные ответы запускаются антигенами. Эти ответы проявляются гуморальными и клеточными реакциями. Гуморальные иммунные ответы выражаются в синтезе антител, которые нейтрализуют антиген, запустивший синтез. Антитела относятся к группе белков, суммарно обозначаемых как иммуноглобулины. Защита с помощью антител может создаваться искусственным путем: после введения сыворотки крови от иммунного (имеющего антитела) индивидуума неиммунному человеку. У последнего в этом случае развивается пассивный иммунитет. Клеточные иммунные механизмы не зависят от выработки антител. Они реализуются с помощью лимфоцитов.
Нормальная защитная реакция на инфекцию включает в себя обе формы иммунного ответа и является сложным процессом, в котором происходит взаимодействие между разными видами лимфоцитов, а также между лимфоцитами, макрофагами и другими клетками.
3) Клеточные основы иммунного ответа (по R.S.Cotran, V.Kumar, T.Collins, 1998) (табл. 5.1). Все специфические иммунные ответы обеспечиваются лимфоцитами. Антитела вырабатываются с помощью В-лимфоцитов, а клеточные иммунные реакции реализуются с помощью Т-лимфоцитов. Указанные лимфоциты часто именуют Ви Т-клетками. Все лимфоциты развиваются в костном мозге из общей клетки-предшественника. Далее происходит дифференцировка (созревание) либо в ткани костного мозга (В-клетки), либо в тимусе (Т-клетки) (схема 5.1). Эти органы обозначают как первичные лимфоидные органы. И гуморальный, и клеточный иммунные ответы нуждаются в единственном покоящемся, или «девственном», лимфоците для связывания с единственной в своем роде антигенной детерминан-той. Такое связывание происходит с помощью специфического рецептора, после чего лимфоцит дает начало большому количеству идентичных дочерних клеток, сохраняющих антигенную специфичность первоначального предшественника. Суммарно эти новые клетки-потомки составляют клон (см. главу 6).
 Именно клональная пролиферация и обеспечивает то, что без утраты специфичности иммунный ответ может быть быстро усилен.
Именно клональная пролиферация и обеспечивает то, что без утраты специфичности иммунный ответ может быть быстро усилен.
Развитие Ти В-клеточных клонов представляет собой сложный процесс пролиферации и дифференцировки. Оно приводит к возникновению популяции коммитирующих (определяющих) эффекторных элементов, функция которых состоит в доведении лимфоцитов до способности к почти полной ликвидации антигена. В системе В-лимфоцитов такими эффектор-ными элементами являются плазматические клетки, а в системе Т-лимфоцитов — цитотоксические Т-клетки и Т-клетки, участ-
Клетки
Характеристика
Добавочные
Активированные лимфоциты
Антигенпредстав-ляющие
В-лимфоциты (В-клетки)
Цитотоксические Т-клетки
Дендритические (дендритные)
Эффекторныс лимфоциты
Фолликулярные дендритические
Иммунобласты Лимфобласты
Макрофаги
Клетки нелимфоцитарной природы, действующие как модуляторы иммунного ответа, функций лимфоцитов, развития тканей. Являются обычно 1а-позитивными. Во многих случаях играют существенную роль в активности хелперных T-клеток на начальных этапах иммунного ответа. Многие добавочные клетки похожи на мононуклеарные фагоциты, но некоторые из них, например дендритические, не являются фагоцитами
Антигенстимулированные лимфоциты, или пролифе-рируюшие в виде властных форм, или принимающие активное участие в иммунном ответе
Нелимфоцитарные клетки, переносящие антиген и представляющие его лимфоцитам, в результате чего развивается иммунный ответ
Лимфоциты, происходящие из костного мозга, но не прошедшие через тимус Играют главную роль в гуморальном иммунитете. После стимуляции антигеном дифференцируются в антигенпродуцирующие плазматические клетки
Подгруппа эффекторных Т-лимфоцитов (обычно CD8), способных к прямому лизису клеток-мишеней. Разрушают клетки, инфицированные вирусами и несущие изологичные (сингенные) антигены класса I (рестрикция HLA)
Фолликулярные дендритические клетки и дендритические клетки белой пульпы селезенки и паракорти-кальной зоны лимфатических узлов. Последний тип относится к добавочным клеткам для активации Т-лимфоцитов
Полностью дифференцированные производные анти-генстимулированных лимфобластов, выполняющие прямые функции в иммунном ответе. Плазматические клетки — «лимфоцитарные эффекторы» В-клеточного ряда
Обнаруживаются в герминативных центрах фолликулов селезенки и лимфатических узлов. Обладают цитоплазматическими отростками, способными долго сохранять антиген
Являются лимфоцитами, стимулированными антигеном, после чего они становятся эффекторными лимфоцитами
Представляют собой бластные элементы лимфопоэза с нежной сетью хроматина и базофильными ядрышками в ядрах. Формируются m vitro и in vivo под воздействием антигенной или митогенной стимуляции. Делятся и образуют популяцию эффекторных лимфоцитов
Составляют многочисленные виды клеток системы мононуклеарных фагоцитов (СМФ). Полагают, что большинство из них — дериваты моноцитов крови
Клетки
Характеристика
Клетки памяти
Естественные
киллеры
(NK-клетки)
Плазматические
Покоящиеся лимфоциты
Т-хелперные
Т-лимфоциты (Т-клетки)
Т-супрессорн ые
«Девственные» лимфоциты
Ти В-клетки, которые опосредуют иммунологическую память
Лимфоидные элементы, уничтожающие чувствительные к ним опухолевые клетки-мишени при отсутствии иммунизации и антигенной специфичности. Содержат в цитоплазме крупные гранулы
Представители конечного этапа дифференцировки В-лимфоцитов, главный клеточный тип по выработке иммуноглобулинов и важнейшие клетки гуморального иммунитета. Встречаются влимфоидных тканях. После антигенной стимуляции их количество возрастает как в зоне входных ворот антигена, так и в дренирующих лимфатических узлах
Малые лимфоциты, находящиеся в фазе Go клеточного цикла. Могут не иметь встречи с антигеном или же представляют собой клетки памяти
Лимфоциты — дериваты тимуса (обычно, с маркером CD4). Их наличие и помощь (help) требуются для выработки В-лимфоцитами антител на нормальном уровне
Лимфоциты — производные тимуса. Играют главную роль как антигенреактивные клетки и эффекторные клетки в клеточно-опосредованном иммунитете и как элементы кооперации с В-лимфоцитами для выработки антител против тимуезависимых антигенов
Субпопуляция Т-лимфоцитов, которая обладает маркером CD8. Эти клетки непосредственно подавляют иммунный ответ
Малые покоящиеся лимфоциты, которые никогда не встречались с антигеном
вующие в реакциях гиперчувствительности. При Т-клеточной дифференцировке также вырабатываются лимфоциты, обладающие регуляторними функциями, — хелперные и супрессорные Т-клетки (оба прилагательных означают «помогающие» и «подавляющие»). Кроме того, клональная пролиферация Ти В-клеток приводит к возникновению популяций антигенспеци-фических клеток памяти. Их функция заключается в быстром ответе на будущее воздействие сушествующего в памяти антигена, иными словами в обеспечении вторичного иммунного ответа. Клеточные механизмы, начинающие свою работу в ходе и после распознавания антигена, реализуются во вторичных лим-фоидных органах — лимфатических узлах, селезенке, небных миндалинах, пейеровых (Е.Реуег) бляшках (групповые лимфатические фолликулы) тонкой кишки и лимфатическом аппарате червеобразного отростка слепой кишки.
4) Строение иммунной системы. Тимус. Элементы стремы этого органа развиваются в очень раннем периоде внутриутробной жизни плода в виде эпителиальных врастаний энтодермы на уровне третьей и четвертой бранхиогенных (жаберных) дуг. Эти врастания подвергаются инфильтрации мезенхимными элементами, имеющими эктодермальное происхождение. На ранних сроках II триместра беременности примитивная строма будущего тимуса заселяется стволовыми клетками гемопоэти-ческого происхождения. После этого орган приобретает характерный вид и строится из отдельных долек, имеющих внешнюю корковую и внутреннюю медуллярную (мозговую) части. В коре тимуса развита сеть эпителиальных клеток. Она содержит также клетки, подобные макрофагам, и включает в себя большинство тимусных лимфоцитов. В клеточных суспензиях, получаемых из ткани тимуса, можно обнаружить элементы, известные как поддерживающие клетки, или «клетки-няньки», представляющие собой конгломераты из лимфоцитов и кортикальных эпителио-цитов. Полагают, что они играют важную роль в дифференци-ровке Т-клеток. Кора тимуса представляет собой зону, в которой происходят и интенсивный лимфопоэз, и значительная часть процесса гибели клеток. Подсчитано, что около 1 \% лимфоцитов, образовавшихся в тимусе, покидают его в виде зрелых Т-клеток (см. раздел о регуляции иммунного ответа). Медуллярная ткань тимуса содержит гораздо меньше лимфоцитов и признаков физиологической смены (оборота) клеток. Она заполнена добавочными клетками, необходимыми для реализации финальных стадий дифференцировки Т-клеток.
Будучи первичным лимфоидным органом, тимус не принимает участия в формировании иммунного ответа на специфические антигены. Его функции, не связанные с антигеном, реализуются почти исключительно в ходе внутриутробной жизни плода или раннем неонатальном периоде. Давно известно, что врожденное отсутствие тимуса (или удаление его при рождении) создает почти полную недостаточность функции Т-клеток. После рождения из этого органа перемешается большое количество Т-клеток в другие (периферические) ткани и органы. В половозрелом организме тимус играет незначительную роль, потому что в большинстве случаев клеточно-опосредованный иммунитет обеспечивается долгоживущими Т-клетками в так называемых периферических тканях.
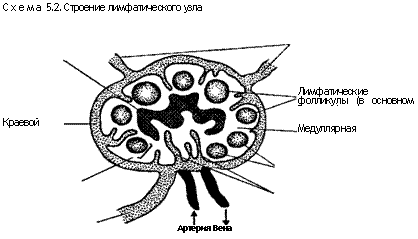
Лимфатические узлы обладают двумя главными функциями — перехватом и удалением инородного материала, проходящего через них в потоке лимфы, а также участием в формировании иммунного ответа.
Каждый такой орган состоит из поверхностной — корковой — и центральной — медуллярной — зон (схема 5.2). Остов органа представлен сетью нежных ретикулиновых волокон, перемежающихся с многочисленными лимфатическими синусами, выстлан-
 |  | ||
 | 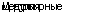 |
ными ретикулярными клетками. Большинство свободных клеток лимфатического узла составляют лимфоциты. В корковой зоне лимфоциты располагаются тесно, а в поверхностных корковых отделах имеются их очаговые скопления, называемые первичными фолликулами. После стимуляции внутри первичных фолликулов появляются округлые зоны лимфопоэза — центры размножения, или герминативные центры. Первоначально фолликулы состоят из В-клеток, хотя там находится и небольшое количество хелперных Т-клеток. Центры размножения содержат В-лимфобласты и фолликулярные дендритические клетки, которые участвуют в улавливании антигена и представлении его В-клеткам.
Более глубокие отделы корковой зоны, называемые иногда паракортикальными, представлены нечетко очерченными моно-морфными участками ткани, лежащей между поверхностной корковой и медуллярной зонами. Эти отделы называют также тимусзависимыми. Они заполнены Т-клетками и взаимовпячи-вающимися (интердигитирующими) дендритными клетками, представляющими антиген Т-клеткам. Паракортикальные отделы сожержат также специализированные кровеносные сосуды, известные как венулы с высоким (кубическим) эндотелием (HEV). Последние являются посткапиллярным отрезком вену-лярного русла, важным для выхода лимфоцитов из кровотока в лимфатические узлы. Лимфа, попадающая в лимфатический узел по приносящим лимфатическим сосудам, поступает в периферический синус, идущий по окружности органа и связанный в зоне ворот с выносящим сосудом. Из периферического синуса дренаж лимфы осуществляется в медуллярную зону по синусам, простирающимся от поверхностных кортикальных участков до глубоких отделов коры. В медуллярной зоне многочисленные лимфатические синусы объединяются в выносящий лимфатический сосуд.
В ответ на местный антигенный стимул, направленный на лимфатические узлы, дренирующие соответствующий регион, в узлах возникают полнокровие, интенсивное накопление лимфоцитов и уменьшение их эмиграции в выносящий сосуд. Этот ответ как своеобразный процесс «выключения», возможно, вызывается антигеном или добавочными клетками, нагруженными антигеном и прибывшими в лимфатический узел по приносящим сосудам. За ним, вероятно, следуют активация антигенспе-цифических Т-клеток и выделение растворимых медиаторов. После этого лимфатические узлы заметно увеличиваются в размерах из-за пролиферации антигенреактивных лимфоцитов. В течение 2 дней активированные Т-клетки (Т-лимфобласты) появляются в паракортикальных отделах, где становятся наиболее заметными примерно через 5 дней. За этот срок многие из Т-лимфобластов обнаруживаются в выносящем сосуде в процессе эмиграции из лимфатического узла. В то же время немалое количество этих клеток остается на месте и дифференцируется в малые Т-клетки памяти, которые затем поступают в фонд рециркуляции (в лимфу и кровь, циркулирующие в замкнутых системах). После короткого интервала описанные изменения в ти-мусзависимой зоне сопровождаются активацией и пролиферацией В-лимфоцитов в фолликулах и последующим появлением центров размножения и плазматических клеток. Кроме того, некоторые В-лимфобласты дифференцируются в малые рецирку-лирующие клетки памяти. Первичная роль центров размножения заключается в создании плазматических клеток, вырабатывающих антитела, и образовании клеток памяти. Успех этой роли зависит от продолжительности задержки антигена на поверхности фолликулярных дендритических клеток. Долгая задержка дает вполне достаточное время для представления антигена В-клеткам в центрах размножения.
Селезенка. Лимфоидная часть селезенки — белая пульпа (лимфоидные фолликулы, имеющие также устаревший синоним — аналог названия почечных клубочков — мальпигиевы тельца; M.Malpighi) — подразделяется на Ти В-клеточные зоны. Т-клетки обнаруживаются в периартериолярных лимфатических оболочках, т.е. вокруг артериол, проходящих в центре лимфоидных фолликулов селезенки. В-клетки определяются в периферических зонах фолликулов. Полоски ткани, располагающиеся между лимфоидными фолликулами и остальной (ретикулярной) тканью органа — красной пульпой — называются маргинальными (краевыми) зонами. Именно здесь происходит важный процесс — эмиграция лимфоцитов крови. В этих зонах можно выявить оседлые {резидентные) В-клетки. Они отличаются от В-клеток фолликулов тем, что не являются рециркуля-торными и тем, что на своей поверхности несут не IgD, a IgM.
Функция этих лимфоцитов в основном связана с иммунитетом против тимуснезависимых антигенов. Белая пульпа селезенки реагирует на антигенную стимуляцию так же, как ее аналог — фолликулы лимфатических узлов (см. выше). Однако, поскольку этот орган сталкивается только с антигенами, циркулирующими в кровотоке, в нем нет приносящих лимфатических сосудов или венул с высоким эндотелием.
Лимфоидные образования в слизистых оболочках. Большинство из существующих антигенов поступает в организм через слизистые оболочки. Для защиты от антигенов во многих таких оболочках имеется развитый и сложный лимфоидный аппарат. Мукозо-ассоциированные лимфоидные ткани (MALT) имеют в своем составе самое большое количество лимфоцитов (по R.N.M.MacSween, K.Whaley, 1994). Они представляют собой диффузно распределенную и самостоятельную части иммунной системы. Некоторая обособленность MALT обусловлена весьма ограниченным обменом лимфоцитами с другими тканями. MALT обладают некоторыми уникальными типами клеток и иммунными механизмами. Например, иммунная система кишечника должна обеспечивать защиту от инвазивных патогенных возбудителей, но в то же время оставаться неактивной по отношению к пищевым антигенам.
MALT имеются в желудочно-кишечном и дыхательном трактах, урогенитальной системе, а также, возможно, в молочной железе и других экзокринных органах, включая слюнные и слезные железы. Из всех органных разновидностей MALT лучше всего изучены кишечно-ассоциированные лимфоидные ткани (GALT). Они состоят из пейеровых бляшек, солитарных лимфоидных фолликулов, брыжеечных лимфатических узлов и червеобразного отростка слепой кишки. Эти образования обладают общими особенностями строения и относятся к вторичным лимфоидным тканям. Правда, некоторые из них, например пейеровы бляшки, могут действовать и как первичные лимфоидные органы, создавая В-клетки. Пейеровы бляшки покрыты кишечным эпителием, отделяющим лим-фоидную ткань от просвета кишки. Этот сводчатый эпителий содержит в своей толще множество лимфоцитов и макрофагов и является местом поглощения антигенов. В толще сводчатого эпителия находится также специализированная популяция из микроскладчатых клеток (М-клетки). Последние, по-видимому, предназначены для обработки антигенов, поступающих из просвета кишки, с помощью множества складок и пор в плазмолемме, замещающих обычные микроворсинки энтероцитов. Антиген, поглощенный М-клетками, очень быстро поступает в пейерову бляшку, в которой переносится к добавочным клеткам.
Кроме GALT, по всей собственной пластинке слизистой оболочки кишечника и по его эпителию рассеяны многочисленные лимфоидные клетки. Собственная пластинка содержит большое количество Ти В-лимфоцитов, плазматических клеток, макро
фагов, тучных клеток и эозинофилов. Примерно 90 \% плазматических клеток вырабатывают антитела класса IgA. У человека это составляет большую часть ежесуточной продукции иммуноглобулинов. Около 15 \% клеток, находящихся в эпителии тонкой кишки, являются лимфоцитами. Практически все интраэпителиаль-ные лимфоциты (ИЭЛ) являются Т-клетками. В отличие от их аналогов в других тканях они экспрессируют маркер CD8 (см. схему 5.1). Функция интраэпителиальных лимфоцитов неизвестна.
Рециркуляция лимфоцитов (схема 5.3). Различные отделы лимфоидной системы в настоящее время не следует рассматривать в отдельности, так как между ними существует постоянный обмен лимфоидными клетками. Такой обмен повышает вероятность встречи с антигеном у небольшого количества анти-генспецифических лимфоцитов, находящихся в любой части организма. Он также позволяет стимулированным лимфоцитам, располагающимся в некоторых специализированных тканях, следовать своим запрограммированным путем дифференцировки.
Малые лимфоциты крови попадают в лимфатические узлы, проходя через HEV, имеющиеся во всех вторичных лимфоид-ных органах, кроме селезенки. Распознавание HEV лимфоцитами, возможно, опосредовано хоуминг-рецепторами (специфическими рецепторами, обеспечивающими возвращение лимфоцитов во вторичные лимфоидные органы), содержащимися на лимфоцитах и эндотелиоцитах HEV (рис. 5.1). Рецепторы вклю
чают в себя молекулы адгезии как лимфоцитов, так и сосудистых клеток (см. главу 2). После прохождения через HEV вплоть до паракортикальных отделов рециркулируюшие лимфоциты мигрируют в соответствующую зону: Т-клетки — в паракорти-кальную ткань, а В-клетки — в зону фолликулов. Затем клетки могут оставаться в лимфатическом узле или же через медуллярный синус выходить в выносящий лимфатический сосуд и возвращаться в венозную систему. Такая же миграция из крови в лимфу встречается в селезенке, но рециркулирующие лимфоциты здесь выходят из капилляров, открытых в красную пульпу или маргинальную зону для того, чтобы затем проникнуть в белую пульпу. Рециркулирующие лимфоциты являются долго-живущими клетками, из которых наибольшую часть составляют клетки памяти с продолжительностью жизни в несколько десятков дней. Наибольшая часть рециркулирующих лимфоцитов представлена Т-клетками, которые способны к более быстрой и эффективной рециркуляции, нежели меньшее количество рециркулирующих В-клеток. Т-лимфобласты не связываются с
HEV и не рециркулируют через лимфоидные органы. Они накапливаются в нелимфоидных тканях, претерпевающих воспалительные изменения. Таким образом лимфоциты, стимулированные в кровотоке или лимфатическом узле, могут быстро мигрировать обратно к месту контакта с антигеном.
Пути специализированной рециркуляции. Лимфоидные ткани, расположенные в слизистых оболочках, не только образуют самостоятельный отдел иммунной системы, но и характеризуются своими, присущими только им путями рециркуляции лимфоцитов. Вили Т-клетки, претерпевшие активацию в пейеровых бляшках (групповые лимфатические фолликулы) или брыжеечных лимфатических узлах, обладают селективной способностью мигрировать в слизистую оболочку кишечника, в то время как лимфобласты из других лимфоидных органов такой способностью не обладают. Несмотря на то что это обстоятельство облегчает размещение IgA-детерминирован-ных В-клеток в местах их воздействия в кишечной стенке, все же в селективной миграции участвуют также и Т-клетки. Поэтому она не является IgA-детерминированной. В слизистой оболочке кишечника нет истинных HEV, но родственные структуры встречаются и здесь. Они обеспечивают специфические лим-фоцитарно-сосудистые взаимодействия.
5) Факторы, воздействующие на иммунный ответ. Форма иммунного ответа зависит от природы антигена, его дозы, пути проникновения в организм, а также от генетической конституции индивидуума.
Антигены. Антигеном считается любая субстанция, способная взаимодействовать с продуктами специфического иммунного ответа, такими как антитела или антигенные рецепторы на лимфоцитах. Другими словами, антигены — это крупные молекулы (с молекулярной массой более 30 KDa), жесткие по структуре и представляющие собой белок или углевод с какими-либо составными частями, например с липидами или без таковых. Реакции антиген — антитело являются результатом стереохимических взаимодействий между молекулами с взаимодополняющей конфигурацией, аналогично взаимодействию ключа и замка. Несмотря на то что все антигены способны к таким взаимодействиям с продуктами иммунного ответа, не каждый из них может вызвать иммунный ответ после своего попадания в организм. Для того чтобы это произошло, антиген должен обладать иммуногеннос-тью. Иммуногены — это те антигены, которые способны запустить иммунный ответ с помощью антигенспецифических рецепторов на лимфоцитах. Отсутствие иммуногенности объясняется или недостаточной величиной молекулы антигена для создания связи с рецепторами или же тем, что соответствующие лимфоциты не могут реагировать на запускающий сигнал.
Несмотря на то что некоторые мелкие молекулы, такие как молекулы парааминобензойной кислоты, сами по себе не иммуногенны, они все же способны становиться таковыми, если прикрепляются к более крупным молекулам, например сывороточного альбумина. В этих обстоятельствах мелкие молекулы становятся гаптенами, т.е. субстанциями, участвующими в специфической иммунологической реакции, но не способными вызвать иммунный ответ
Изучение синтетических полипептидных и полисахаридных антигенов показало, что их распознавание зависит от трехмерной конфигурации небольшого количества аминокислот и моносахаридов. Макромолекулы, встречающиеся в естественных условиях, имеют несколько таких мест, которые могут распознаваться иммунной системой. Каждое такое место (сайт) называется антигенной детерминантой, или эпитопом. Крупные и сложные антигенные частицы и живые организмы, например бактерии, содержат огромное количество разнообразных эпито-пов. Они являются по сравнению с мелкими растворимыми молекулами значительно более сильными иммуногенами. Изменения, происходящие даже в одной аминокислоте или сахарной цепи антигенной детерминанты, способны приводить к утрате реактивности антигена с антителом или лимфоцитами. Все это иллюстрирует специфичность иммунного ответа.
Пути поступления антигена в организм оказывают влияние на иммунный ответ и с качественной, и с количественной стороны. Возможно, это обусловлено различиями у добавочных клеток, встречающих антиген и участвующих в его представлении. Подкожный, внутримышечный и внутрикожный пути поступления антигена, как правило, сопровождаются сильно выраженными иммунными ответами, в то время как внутривенное попадание (или введение) антигена обычно вызывает слабое ответное образование антител и специфическую иммунологическую толерантность. Небольшие объемы растворимых антигенов, поступающих через рот, но избегающих разрушения пищеварительными соками и потому всасываемых, как правило, тоже вызывают иммунологическую толерантность. Однако живые организмы и антигены из плотных частиц стимулируют активные иммунные ответы при попадании на поверхность слизистых оболочек. Мукозные иммунные реакции обычно ограничены пределами поверхности слизистой оболочки, которая первой встречает антиген, в то время как парентеральный путь попадания антигена редко вызывает реакцию слизистых оболочек.
Доза вводимого антигена. Чем выше доза антигена, попадающего в организм, тем сильнее иммунный ответ. Однако исключительно малые или, наоборот, слишком большие дозы антигена могут приводить к иммунологической толерантности.
Роль генетической конституции человека. Разнообразие специфических иммунных ответов, которые могут проявляться у индивидуума, зависит от некоторых генетически детерминированных факторов. Последние включают в себя различные антигенсвязывающие сайты, имеющиеся и на молекулах антител, и на рецепторах поверхности Т-клеток. Иммунитет ко многим патогенным возбудителям может быть также детерминирован генами, контролирующими неспецифические иммунные факторы, например фагоцитарную и расщепляющую функции макрофагов. Кроме того, гены специфического иммунного ответа (Ir-гены), локализующиеся внутри главного комплекса гистосов-местимости (ГКГС) на хромосоме 6, хотя и не кодируют антигенсвязывающие сайти антител или Т-клеток, но оказывают влияние на представление антигенов этим клеткам.
Тканевые антигены. Когда клетки или ткани, взятые от одного индивидуума, вводят или пересаживают другому, в большинстве случаев отмечается быстрый иммунный ответ, который вызывает отторжение трансплантата. Чем больше выражены индивидуальные генетические различия, тем сильнее проявляется иммунный ответ. Терминология, которая используется для характеристики таких генетически детерминированных иммунных ответов, отражена в табл. 5.2. Если антиген или ткань происходят из источников, отличающихся от иммунизируемого хозяина, они
Таблица 5.2. Важнейшие группы антигенов, антител н тканевых трансплантатов
Доноры и реципиенты
Генетические обозначения
Обозначения антител и антигенов
Названия трансплантатов
Один и тот же организм
Однояйцевые (ин-бредные, монозиготные) близнецы или представители одного и того же родственного (ин-бредного) штамма
Неродственные (аутбредные) организмы одного вида или различные ин-бредные штаммы одного вида
Представители разных видов
Сингенные (изогенные или изоло-гичные) организмы или их части
Аллогенные организмы или их части (относящиеся к другой особи того же вида)
Гетерогенные (ксеногенные) организмы или их части
Аутоантигены (собственные антигены организма Аутоантитела
Изоантигены (или аллогенные, гомологичные, групповые антигены) Изоантитела (или изоиммунные, изо-логичные антитела)
Гетероантигены Гетероантитела
Аутотрансплантат (ткань или орган, пересаженный в пределах одного организма)
Изотрансплантат (биологически совместимая ткань для донора и реципиента)
Аллотрансплан-тат (гомотранс-плантат)
Гетероили ксе-нотрансплантат (например, опухоль человека, пересаженная подопытной мыши)
называются гетероантигенами, а антитела, возникающие в таком случае, именуются гетероантителами. К этому типу относятся антитела, возникающие против бактерий. Антигены, имеющие внутривидовые различия, называются аллоантигенами, а соответствующие антитела — аллоантителами. Как правило, аллоантиге-ны вызывают иммунный ответ с меньшей вероятностью, чем гете-роантигены. Здоровый человек обычно не дает реакции на антигены собственных клеток, поскольку во время развития плода эти тканевые антигены вызывают скорее специфическую иммунологическую толерантность, нежели активный иммунитет. Поэтому введение человеку собственных клеток или тканей — аутоантиге-нов — в нормальных условиях не приводит к аутоиммунному ответу. А если последний все-таки развивается, то значит речь идет о каком-либо из аутоиммунных заболеваний.
Главный комплекс гистосовместимости. ГКГС включает ряд генов, кодирующих группу высокополиморфных гликопротеинов плазмолеммы. У человека эти антигены ГКГС называют лейкоцит-ассоциированными, или HLA-антигенами. Они играют ключевую роль в иммунном распознавании. Комплекс генов ГКГС, локализующийся на коротком плече хромосомы 6, включает в себя три группы (три класса) генов — I, II и III. Весь район ГКГС занимает примерно ЗхЮ6 пар оснований (3 МЬр) (см. главу 8). Районы I и II классов разделяются районом III класса, содержащим гены, кодирующие С4, С2, фактор В (Bf), белок теплового удара 70 (HSP 70), ФНОа и р. Гены из районов I и II классов кодируют белки, занимающиеся распознаванием антигена, а белки, кодируемые генами района III класса, имеют отношение к эффекторному плечу иммунного ответа и тканевому ответу на повреждение.
Антигены ГКГС I класса выявляются на всех клетках, имеющих ядра, и кодируются генами районов А, В и С в локусе HLA (схема 5.4). Указанные гены кодируют полиморфную трансмембранную гликопептидную цепь с молекулярной массой 44 KDa (изменчивую а-цепь), которая связана нековалентной связью с меньшей и неменяющейся цепью ^>2-микРогл°булина, кодируемой в свою очередь геном на хромосоме 15. а-Цепь проникает через плазмолемму, в то время как р-цепь лишь связана с ней и не прикрепляется к мембране. Поскольку аллель I класса экс-прессируется кодоминантным образом, ткани человека несут антигены обоих родителей.
Антигены ГКГС II класса иногда называют 1а-антигенами (иммуноассоциированными). Они кодируются генами, расположенными в районе HLA-D, состоящем по крайней мере из трех главных локусов: DP, DQ и DR (схема 5.5). Эти антигены обладают экспрессией устанавливающего характера на В-клетках, макрофагах и дендритических клетках лимфоидных органов и участвуют в представлении антигена Т-лимфоцитам. Некоторые
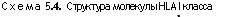 | |||
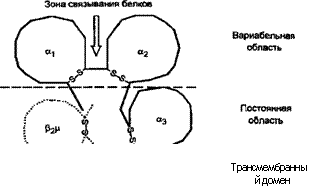 | |||
а цепь нековалентно связана с р2-микроглооулином.
Зона связывания белков сформирована углублением внеклеточной части
молекулы с участками доменов а, и а2
Схема 5.5. Структура молекулы HLA II класса
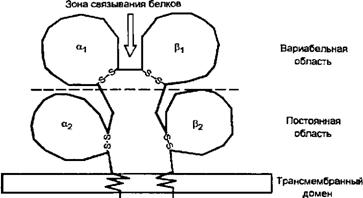
Цитоплаэматический домен
Две нековалентно связанные а и р-цели.
Зона связывания белков сформирована углублением внеклеточной части молекулы с участками доменов аир другие клетки способны экспрессировать антигены II класса в случае их стимуляции у-интерфероном. Антигены II класса состоят из двух нековалентно связанных трансмембранных глико-пептидных цепей: а (34 KDa) и р* (29 KDa), каждая из которых кодируется на хромосоме 6. Обе цепи проникают через плазмо-лемму клеток. Подобно антигенам I класса, аллели II класса экспрессируются тоже кодоминантным образом.
 6) Гуморальный иммунитет. Строение антител. Молекулы антител обладают специализированным свойством соединяться с антигеном. В ходе такого соединения они могут закрывать активные зоны на молекулах токсинов. В этом случае их называют антитоксинами. Кроме того, образование комплекса молекул антиген — антитело с помощью активации системы комплемента (см. главу 4) или опсонизации способно приводить к гибели, лизису или фагоцитозу возбудителя полиморфно-ядерными лейкоцитами и макрофагами. Известно, что с биохимической точки зрения антитела относятся к иммуноглобулиновым (Ig) белкам плазмы и что в настоящее время выделяют 5 классов антител: IgG, IgM, IgA, IgD и IgE (табл. 5.3).
6) Гуморальный иммунитет. Строение антител. Молекулы антител обладают специализированным свойством соединяться с антигеном. В ходе такого соединения они могут закрывать активные зоны на молекулах токсинов. В этом случае их называют антитоксинами. Кроме того, образование комплекса молекул антиген — антитело с помощью активации системы комплемента (см. главу 4) или опсонизации способно приводить к гибели, лизису или фагоцитозу возбудителя полиморфно-ядерными лейкоцитами и макрофагами. Известно, что с биохимической точки зрения антитела относятся к иммуноглобулиновым (Ig) белкам плазмы и что в настоящее время выделяют 5 классов антител: IgG, IgM, IgA, IgD и IgE (табл. 5.3).
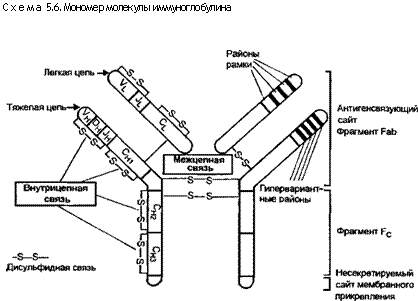 Все иммуноглобулины построены из одной или нескольких сходных единиц, каждая из которых состоит из двух пар идентичных полипептидных цепей (схема 5.6). Одна пара — тяжелые цепи — обладает молекулярной массой, превышающей таковую другой пары — легких цепей — примерно в 2 раза. В свою очередь каждая цепь составлена из более мелких субъединиц (доменов), имеющих сходную общую структуру и форму, а также характерную внутрицепную дисульфидную связь. Тяжелые цепи у каждого класса иммуноглобулинов имеют структурные отличия. Для их обозначения используют греческие буквы: у (гамма), р (ми), а (альфа), 5 (дельта) и є (эпсилон). В противоположность тяжелым цепям во всех классах антител имеются лишь два типа легких цепей — к (каппа) и л. (ламбда), и каждая молекула иммуноглобулина обладает кили А,-цепью.
Все иммуноглобулины построены из одной или нескольких сходных единиц, каждая из которых состоит из двух пар идентичных полипептидных цепей (схема 5.6). Одна пара — тяжелые цепи — обладает молекулярной массой, превышающей таковую другой пары — легких цепей — примерно в 2 раза. В свою очередь каждая цепь составлена из более мелких субъединиц (доменов), имеющих сходную общую структуру и форму, а также характерную внутрицепную дисульфидную связь. Тяжелые цепи у каждого класса иммуноглобулинов имеют структурные отличия. Для их обозначения используют греческие буквы: у (гамма), р (ми), а (альфа), 5 (дельта) и є (эпсилон). В противоположность тяжелым цепям во всех классах антител имеются лишь два типа легких цепей — к (каппа) и л. (ламбда), и каждая молекула иммуноглобулина обладает кили А,-цепью.
Антигенный рецептор на В-клетках представляет собой мономер IgM (±IgD) (мономер — общее название низкомолекулярных соединений, например аминокислот). Специфичность комплекса антиген — антитело зависит от соединяющего сайта антитела, который имеет форму, соответствующую антигенной детерминанте и позволяющую закрыть зону соответствия. Форма соединяющего сайта детерминируется аминокислотной последовательностью N-терминальных окончаний тяжелых и легких цепей. В отличие от большинства других белков, каждый из которых у конкретного индивидуума имеет одинаковую аминокислотную последовательность, иммуноглобулины обнаруживают заметную гетерогенность своих N-терминальных доменов (изменчивых районов). Эта гетерогенность насчитывает до нескольких миллионов вариантов, большинство из которых встречается в 3—4 (гипервариантных) районах. Каждая пара тяжелых и легких цепей складывается таким образом, что для составления антигенсвязующего сайта в интактной и противостоящей молекулах открыты гипервариантные районы. Такое разнообразие лежит в основе широкого набора антител, которые могут возникать в ответ на стимуляцию громадным количеством антигенов.
По результатам исследования антител, развивающихся против гаптенов, биохимическая структура которых известна, можно прийти к выводу о специфичности комплекса антиген — антитело. Устойчивость соединения антигенсвязующих сайтов антитела и антигена (устойчивость иммунологического сродства) зависит от степени закрытия зоны соответствия. Антитела могут быть близкородственными (обладать высокой степенью сродства) или отдаленно родственными (с низкой степенью сродства). Перекрестные реакции обычно происходят при низкой степени сродства.
Иммуноглобулин G (IgG) является мономером. Этого иммуноглобулина больше всего в плазме крови и внесосудистой жидкости. На макрофагах и полиморфно-ядерных лейкоцитах имеются Fc-рецепторы для зоны Fc молекулы IgG. Эти рецепторы облегчают прикрепление и фагоцитоз соответствующих антигенов. IgG дает перекрестную реакцию с плацентой человека через рецепторы Fc-y, перенося свойства пассивного иммунитета от матери к ребенку. Имеются четыре подкласса IgG, которые различаются своими свойствами (табл. 5.4).
 Иммуноглобулин М (IgM) представляет собой макроглобулин и является первым классом молекул, вырабатываемых после первоначального попадания антигена в организм, поэтому он наиболее важен в первичном иммунном ответе. Наличие антител IgM к микроорганизму свидетельствует о недавней или продолжающейся инфекции IgM обладает десятью сайтами соединения. Поэтому сила его связывания с молекулами антигена очень высока. Иными словами, ему свойственна высокая авид-ность (степень сродства) к соответствующему антигену. IgM является также наиболее эффективным иммуноглобулином в активации комплемента. Из-за размера молекулы распространение IgM ограничено главным образом пределами плазмы крови, в которой он реализует важнейшие функции по разрушению микроорганизмов. Мономерный IgM имеется на плазмолемме В-клеток. Здесь он действует в качестве рецептора антигена.
Иммуноглобулин М (IgM) представляет собой макроглобулин и является первым классом молекул, вырабатываемых после первоначального попадания антигена в организм, поэтому он наиболее важен в первичном иммунном ответе. Наличие антител IgM к микроорганизму свидетельствует о недавней или продолжающейся инфекции IgM обладает десятью сайтами соединения. Поэтому сила его связывания с молекулами антигена очень высока. Иными словами, ему свойственна высокая авид-ность (степень сродства) к соответствующему антигену. IgM является также наиболее эффективным иммуноглобулином в активации комплемента. Из-за размера молекулы распространение IgM ограничено главным образом пределами плазмы крови, в которой он реализует важнейшие функции по разрушению микроорганизмов. Мономерный IgM имеется на плазмолемме В-клеток. Здесь он действует в качестве рецептора антигена.
Иммуноглобулин A (IgA) является главным антителом, вырабатываемым на поверхности слизистых оболочек, и вторым по значению (после IgG) иммуноглобулином в плазме крови. Он встречается в двух основных формах: циркуляторного IgA, являющегося мономером, и секреторного IgA — продукта различных желез, имеющего димерную молекулу. При прохождении через эпителий слизистых оболочек к нему присоединяется добавочный белок — секреторный компонент (SC). Небольшая часть сывороточного IgA тоже димерна, но не содержит SC. У IgA имеется два подкласса: IgA, и IgA2, которые в равных количествах содержатся в плазме, в то время как в секреторных продуктах преобладает IgA2.
Димерный IgA синтезируется плазматическими клетками в собственной пластинке слизистой оболочки кишечника, дыхательного и мочевыводящего трактов. Затем этот иммуноглобулин в большом количестве выделяется в просвет кишечника и других трактов, что достигается с помощью двух специфических транспортных систем.
Первая система: местно вырабатываемый IgA получает доступ в просвет органа благодаря предварительному комплекси-рованию с SC; последний действует в качестве рецептора на базальной поверхности эпителиоцитов и является высокоспецифичным по отношению к полимерному иммуноглобулину, в частности к димеру IgA; IgA подвергается затем эндоцитозу и транспортируется к поверхности просвета органа, здесь SC частично связывается, а освобожденный комплекс IgA—SC выделяется в просвет органа, где улавливается слоем слизи. Полагают, что, помимо своей транспортной функции, SC защищает молекулу IgA от протеолиза. Среди других классов иммуноглобулинов только полимерный IgM может быть транспортирован через эпителий слизистой оболочки в просвет органа.
Вторая система: IgA может достигать просвета кишечника и иных трактов по непрямому пути; димерный IgA, вырабатываемый в собственной пластинке слизистых оболочек, просачивается в кровоток портальной системы, удаляется гепатоцитами и после комплексирования с SC на каналикулярной поверхности гепатоиитов быстро направляется в желчь. Этот механизм объясняет не только низкое содержание димерного IgA в сыворотке крови, но и высокие сывороточные уровни этого иммуноглобулина при болезнях печени.
Функции IgA полностью не изучены. Прикрепляясь к эпителию слизистых оболочек, он формирует важную часть мукозно-го защитного барьера и способен действовать в качестве невоспалительного элиминатора патогенных возбудителей. Этот иммуноглобулин не активирует комплемент, но может обладать опсонической активностью, поскольку его рецепторы имеются на нейтрофилах. IgA способен также к нейтрализации бактерий и вирусов.
Иммуноглобулин E(g¥). IgE присуще специфическое свойство прикрепляться к тучным клеткам и базофильным лейкоцитам с помощью Fc-фрагмента. При этом специфические сайты соединения остаются открытыми для антигенов. Антитела IgE участвуют в реакциях гиперчувствительности немедленного типа (ГНТ).
Иммуноглобулин D (IgD). Биологические свойства циркуля-торного IgD неизвестны. Но на В-клетках, на которых он обнаружен вместе с IgM, циркуляторный IgD действует как рецептор антигена.
Выработка антител. Попадание в организм антигена, с которым человек ранее не встречался, приводит к первичному антительному ответу. Во время такого ответа, примерно через 7 дней после попадания антигена в организм, в крови появляется небольшое количество специфических антител IgM. Повторное попадание того же антигена в организм в более отдаленный срок приводит ко вторичному, или анамнестическому, ответу (ответ памяти). Появляются уже большие количества специфического IgG. Такой вторичный ответ развивается примерно через 4 дня и может продолжаться несколько недель.
При выработке антител происходят пролиферация и диффе-ренцировка (созревание) В-клеток. Последние становятся лим-фобластами и дифференцируются в В-лимфоциты памяти или в плазматические клетки, содержащие в своей цитоплазме развитую эндоплазматическую сеть. Антитела, циркулирующие в кровотоке, в основном вырабатываются плазматическими клетками селезенки, костного мозга и лимфатических узлов. Однако указанные клетки определяются также в изобилии в лимфатических образованиях слизистых оболочек; известно, что их бывает много и в зонах воспаления. Каждая плазматическая клетка постоянно продуцирует легкие цепи — к или X, но никогда те и другие одновременно — вместе с тяжелыми цепями лишь одного класса иммуноглобулинов (табл. 5.5).
7) Клеточно-опосредованный иммунитет. Т-л и м ф о ц и т ы. Различные эффекторные функции, относимые к клеточно-опосредованному иммунитету, подчинены Т-клеткам, которые
играют центральную роль в регуляции специфического иммунного ответа и ответственны за стимуляцию многих неспецифических механизмов воспаления. На Т-клетки приходится около 70 \% лимфоцитов периферической крови, и внутри их популяции имеется значительная разнородность (табл. 5.6).
 Существует две главные группы эффекторных Т-клеток (эф-фекторные — в данном случае не только совершающие действие, но и опосредующие): цитотоксические Т-лимфоциты (CTL), непосредственно лизирующие соответствующие клетки-мишени, способные к уничтожению некоторых клеток злокачественных опухолей и трансплантатов, а также Т-клетки, опосредующие ответы гиперчувствительности замедленного типа (ГЗТ). Ответы ГЗТ осуществляются с помощью выработки растворимых медиаторов и цитокинов, которые способствуют восполнению и активации клеток неспецифического воспалительного ответа, прежде всего макрофагов. Реакции ГЗТ чрезвычайно важны для защиты от всевозможных возбудителей, склонных к внутриклеточному паразитированию (см. главу 14), а также при отторжении трансплантатов и аутоиммунных реакциях.
Существует две главные группы эффекторных Т-клеток (эф-фекторные — в данном случае не только совершающие действие, но и опосредующие): цитотоксические Т-лимфоциты (CTL), непосредственно лизирующие соответствующие клетки-мишени, способные к уничтожению некоторых клеток злокачественных опухолей и трансплантатов, а также Т-клетки, опосредующие ответы гиперчувствительности замедленного типа (ГЗТ). Ответы ГЗТ осуществляются с помощью выработки растворимых медиаторов и цитокинов, которые способствуют восполнению и активации клеток неспецифического воспалительного ответа, прежде всего макрофагов. Реакции ГЗТ чрезвычайно важны для защиты от всевозможных возбудителей, склонных к внутриклеточному паразитированию (см. главу 14), а также при отторжении трансплантатов и аутоиммунных реакциях.
Различают по меньшей мере две группы регуляторних Т-клеток. Хелперные Т-лимфоциты (Th) помогают в выработке антител в ответ на воздействия большинства антигенов (отсюда и название «to help» — помогать). Супрессорные Т-клетки (Ts), по-видимому, играют роль в предотвращении аутоиммунных реакций и в регуляции общего уровня и устойчивости защитных иммунных ответов (их название возникло от глагола to suppress — подавлять, сдерживать).
Фенотипические признаки Т-клеток. При использовании традиционных обзорных гистологических и цитологических окрасок (см. главу 1) различить различные классы лимфоцитов практически невозможно. Иное дело, если применять иммуногистохимические методы. Так, в отличие от В-кле-ток у Т-лимфоцитов нет поверхностного иммуноглобулина. Т-клетки обладают также поверхностным рецептором, позволяю-
7. Пальцев, т. 1.
193
щим им in vitro связываться с эритроцитами барана. Ранее эта способность использовалась для отличения Т-лимфоцитов от В-клеток. В настоящее время с помощью моноклональных антител, применяемых в иммуногистохимических реакциях, можно определить множество разнообразных поверхностных антигенов, специфичных только для Т-клеток. Каждый из этих антигенов обозначается как кластер дифференцировки (CD), имеющий свой порядковый номер (см. схему 5.1; табл. 5.5).
Т-клетки можно выявить по наличию поверхностного антигена CD3, связанного с их антигенным рецептором. Кроме того, на всех Т-лимфоцитах обнаруживаются CD2 — рецептор для В-клеток, способных к специфическому ответу (SRBC), и кластер CD5. Три указанных кластера называют пан-Т-клеточными маркерами. Для надежной же идентификации Т-лимфоцитов опираться только на эти маркеры нельзя, так как они иногда выявляются и на других лимфоцитах.
Более 95 \% зрелых Т-клеток экспрессируют молекулы или CD4, или CD8, но никогда оба маркера одновременно. Основная роль этих молекул состоит в том, чтобы направлять Т-лим-фоциты для распознавания инородного антигена при его взаимодействии с молекулами разных классов ГКГС. Методически взаимоисключаемые подгруппы Т-клеток (CD4+ или CD8+) часто принимают соответственно за функционирующие хелпер-ные Т-лимфоциты или цитотоксические супрессорные Т-клетки. Несмотря на общую закономерность такой связи, все же показано, что встречаются и обратные варианты: (С08+)-хелпер-ные и (С04+)-цитотоксические клетки. Для отличения девственных, покоящихся Т-лимфоцитов, экспрессирующих CD45RA — одну из форм кластера CD45, от клеток памяти, экспрессирующих другую форму того же кластера CD45RO, используют реакции с общим лейкоцитарным антигеном CD45.
Распознавание антигена Т-клетками. Строение Т-клеточного антигенного рецептора (TcR). Около 95 \% Т-клеток периферической крови носят TcR, представляющий собой гетеро-димер, образованный а и р-цепями, связанными между собой ди-сульфидной связью (схема 5.7). Обе цепи имеют молекулярную массу 40—45 KDa и включают в себя два иммуноглобулиноподоб-ных домена. Каждый домен обладает дисульфидной связью внутри цепи и значительной гомологичностью (соответствием) индивидуальным иммуноглобулиновым цепям. Каждая из цепей TcR имеет цитоплазматический хвост — неизменный трансмембранный район, а также дистальный внеклеточный домен V. Последний варьирует гораздо заметнее у различных Т-клеток, нежели более проксимальный постоянный домен С.
Оставшиеся 5 \% зрелых CD3+ Т-клеток не экспрессируют а-р-форму TcR, но имеют альтернативную его форму, включающую в себя уи 8-цепи. Большинство из у-8-Т-клеток не экспрессируют молекулы CD4 или CD8 и представляют собой
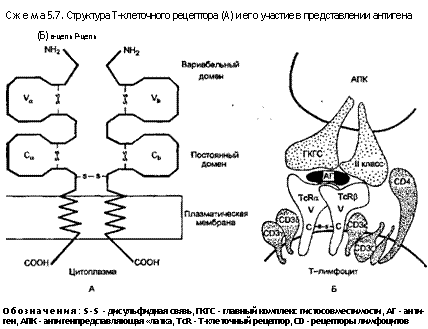 отдельную линию а-р-Т-клеток. Однако уи б-цепи имеют такую же общую структуру белка, что и аи р-молекулы. Фиксация у-8-Т-клеток неизвестна, однако они появляются на ранних стадиях онтогенеза.
отдельную линию а-р-Т-клеток. Однако уи б-цепи имеют такую же общую структуру белка, что и аи р-молекулы. Фиксация у-8-Т-клеток неизвестна, однако они появляются на ранних стадиях онтогенеза.
8) Рестрикция (ограничение) главного комплекса гистосовместимости (ГКГС). Т-клетки способны связываться с антигеном, только если он представлен на поверхности другой клетки в форме комплекса с молекулой ГКГС. Такое «ограничение ГКГС» зависит от способности Т-клеток связывать сингенные молекулы ГКГС, имеющие слабое сродство. Несмотря на относительно слабый характер этой реакции, она может усиливаться, если молекула ГКГС слегка изменена из-за наличия антигенного пептида в углублении поверхности молекулы ГКГС. Эта молекула подвергается рестрикции, и TcR взаимодействует как с антигенным пептидом, так и с окружающими петлями молекулы ГКГС. Рассмотрим два вида рестрикции II и I классов ГКГС
Рестрикция II класса ГКГС. С04+Т-клетки распознают малые антигенные пептиды, состоящие из 10—15 аминокислот и связанные с молекулами II класса ГКГС. Вспомогательные клетки поглощают экзогенный растворимый антиген с помощью пиноцитоза, а гранулярные формы антигена — с помощью фагоцитоза. Поглощенный антиген поступает в эндосомальные везикулы, в которых подвергается частичному протеолизу. Образующиеся в результате этого пептиды обретают связь с вновь
7*
195
синтезированными молекулами II класса ГКГС, когда пептид-содержащие эндосомы сливаются с пузырьками комплекса Гольджи (см. главу 2). Комплекс пептид—ГКГС транспортируется и встраивается в плазмолемму вспомогательной клетки для распознавания с помощью CD4+ Т-клеток.
Рестрикция I класса ГКГС. С08+Т-клетки распознают антигенные пептиды, содержащие 9—10 аминокислотных остатков, которые образуются из белков, синтезируемых внутри клеток, например из вирусных белков в клетке, инфицированной вирусом. Эти эндогенные пептиды проникают в эндоплазматичес-кую сеть. Там они комплексируются с вновь синтезируемыми молекулами I класса ГКГС и транспортируются к плазмолемме для распознавания CD8+ Т-клетками.
9) Происхождение антигенпредставляющих клеток (АПК). Роль этих клеток состоит в обработке антигенных пептидов до размеров, формы и физико-химических свойств, обеспечивающих их вставление в молекулу ГКГС. Клетка, представляющая антиген, создает условия, необходимые для активации Т-клеток, с помощью формирования стабильной связи с антигенспе-цифической Т-клеткой и продукции костимулирующих (содружественно стимулирующих) факторов. Наличие молекул I класса ГКГС практически на всех клетках, имеющих ядра, и способность этих молекул связываться с белками — производными цитоплазмы означают, что большинство метаболически активных тканевых клеток потенциально способны к представлению антигена С08+Т-клетками (понятием «тканевые клетки» в современной иммунологии обозначают элементы, не относящиеся к системам крови и кроветворения) (схема 5.8).
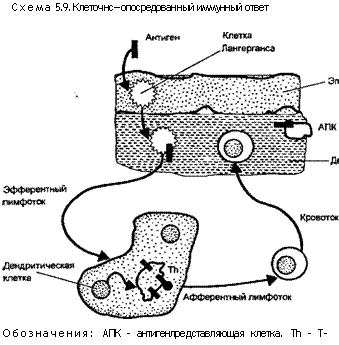
Весьма ограниченное количество клеточных типов сталкивается с более строгими запросами С04+Т-клеток, адресуемыми антиген представляющим клеткам. Такие антигенпредставляю-щие элементы должны экспрессировать антигены II класса ГКГС и способны поглощать и обрабатывать сложные антигены. Они продуцируют ряд костимулирующих факторов, необходимых для полной активации Т-клеток. Среди этих факторов лучше всего изучен ИЛ-1. Среди антигенпредставляющих клеток лучше всего охарактеризованы интердигитирующие дендритические клетки, выявляемые в Т-клеточных зонах лимфоидных органов («интердигитации» — это пальцевидные взаимовпячи-вания цитоплазмы соседних клеток). Сходные дендритические клетки макрофагальной природы можно обнаружить и в других тканях. Одним из наиболее изученных типов дендритических элементов является клетка Лангерганса (P.Langerhans) эпидермиса. Эти клетки принимают антиген, направленный или относящийся к коже, а затем мигрируют в дренажный лимфатический узел (коллектор) через приносящие лимфатические сосуды (схема 5.9). В дренажном коллекторе клетки Лангерганса дифференцируются в интердигитирующие дендритические клетки и
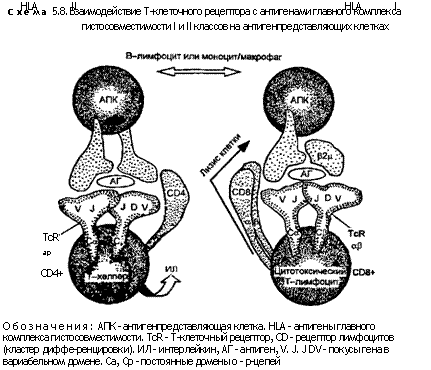 только тогда становятся полностью способными к активации Т-клеток. Сходный путь, по-видимому, используется на поверхностях слизистых оболочек в желудочно-кишечном и дыхательном трактах, где эти оболочки контактируют с большим количеством всевозможных антигенов.
только тогда становятся полностью способными к активации Т-клеток. Сходный путь, по-видимому, используется на поверхностях слизистых оболочек в желудочно-кишечном и дыхательном трактах, где эти оболочки контактируют с большим количеством всевозможных антигенов.
Дендритические клетки представляют собой не единственные антигенпредставляющие элементы, способные к активации С04+Т-клеток. В связи с отсутствием в их цитоплазме лизосо-мальных ферментов, требуемых для переваривания более сложных антигенов, например бактерий, необходимо присутствие тканевых макрофагов. При определенных обстоятельствах макрофаги сами могут действовать как антигенпредставляющие клетки. Поскольку макрофаги экспрессируют молекулы II класса ГКГС после активации медиаторами Т-клеток, например у-интерфероном, представление антигена на их поверхности происходит главным образом в очагах хронического воспаления.
В-клетки тоже способны представлять антиген С04+Т-клет-кам. Это может иметь существенное значение для индукции большинства первичных иммунных ответов. Давая положительную реакцию ко II классу ГКГС, В-клетки могут представлять подчас широкий спектр экзогенных антигенов после неспеци
 |
фического поглощения (см. выше). Однако антигенспецифич-ные В-клетки обладают дополнительным преимуществом, выражающимся в возможности концентрации соответствующего антигена на их поверхности с помощью прикрепления к поверхностному иммуноглобулину. В результате представление В-лим-фоцитами специфического антигена С04+Т-клеткам оценивается как в тысячи раз более эффективное, нежели представление других неспецифических антигенов.
Многие типы клеток: кератиноциты эпидермиса, эпителий кишечника, щитовидной железы и почечных канальцев, клетки островков поджелудочной железы, эндотелий сосудов — могут факультативно (не обязательно) секретировать антигены II класса ГКГС. Это встречается при аутоиммунных состояниях и других формах иммуноопосредованного воспаления, например при отторжении трансплантата или болезни трансплантат против хозяина. Подобная факультативная экспрессия антигенов II класса ГКГС не приводит к запуску иммунного ответа, но может оказывать усиливающее иммунопатологическое влияние с помощью дальнейшей стимуляции Т-клеток. Полагают также, что молекулы II класса ГКГС, экспрессирующиеся на так называемых тканевых клетках (см. выше), способны регулировать воспалительный ответ путем торможения активации Т-клеток.
Активация Т-к леток. Несмотря на то что распознавание антигена с помощью ГКГС и TcR дает первоначальный стимул для активации Т-клеток, этого еще недостаточно, чтобы вызвать их пролиферацию. Размножение Т-клеток требует наличия определенных неспецифических костимулирующих факторов. Некоторые из таких факторов (цитокинов), в частности ИЛ-1, вырабатываются антигенпредставляющими клетками после взаимодействия с Т-клетками. Последующее связывание рецептора CD28 на Т-клетках усиливает костимулирующую функцию. У СВ4+Т-клеток такая последовательность событий быстро вызывает синтез множества медиаторов, продолжающих процесс стимуляции. Наиболее важным из этих медиаторов считается ИЛ-2 — фактор роста Т-клеток. Он абсолютно необходим для репликации и завершения дифференцировки Т-лим-фоцитов. Одновременно с продукцией ИЛ-2 Т-клетки экспрес-сируют рецепторы для этого цитокина, подвергаясь аутокрин-ной стимуляции. Секретируемый ИЛ-2 оказывает стимулирующее паракринное воздействие на те Т-клетки, которые экспрес-сируют рецепторы для ИЛ-2. Таким образом он усиливает местный ответ. Другой медиатор Т-клеточного происхождения — ИЛ-4 — обладает сходными аутои паракринными воздействиями на некоторые Т-лимфоциты.
Пролиферация С08+Т-клеток также регулируется ИЛ-2. Однако лишь небольшая часть таких клеток вырабатывает этот цито-кин. Поэтому для пролиферации и дифференцировки указанных клеток требуется наличие С04+Т-клеток, секретирующих ИЛ-2.
Функции активированных Т-клеток. В иммунном ответе Т-клетки играют двоякую роль — эффекторную и иммунорегулятор-ную. Эффекторные Т-клетки, определяющие клеточно-опосредо-ванный иммунный ответ, включают две отчетливые группы элементов: цитотоксические Т-клетки и Т-клетки, вырабатывающие цитокины (Т-клетки, участвующие в ГЗТ). Рассмотрим обе группы.
Цитотоксические Т-клетки (CTL) представляют собой популяцию полностью диффере
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
