7.6. биология опухолевого роста
7.6. биология опухолевого роста
Молекулярные основы изменений генои фенотипа клеток при доброкачественных опухолях, равно как и биология их роста, гораздо менее изучены чем при злокачественных опухолях. Это и понятно. Слишком велико значение злокачественных новообразований в патологии человека.
Естественное развитие большинства злокачественных опухолей проходит четыре главные фазы: малигнизацию клеток-мишеней, обозначаемую как трансформация, рост трансформированных клеток, местную инвазию и развитие дистантных метастазов. Молекулярные основы трансформации рассмотрены в предыдущем разделе главы. Далее речь пойдет о факторах, способствующих росту трансформированных клеток, и биомолекулярных механизмах инвазии и метастазирования.
Формирование опухолевого узла из клональных потомков трансформированной клетки — это сложный процесс, на который влияет множество факторов. Некоторые процессы, например, удвоение жизни малигнизированных клеток, являются для них внутренними, другие же, например ангиогенез, отражают реакцию микроокружения, вызванную опухолевыми клетками или их продуктами.
Кинетика роста опухолевых клеток. Рассмотрение динамики увеличения опухолевой клеточной популяции следует начать с непростого вопроса: сколько нужно времени, чтобы растущая масса опухолевых клеток проявила бы себя клинически? Мало сосчитать, что трансформированная клетка-источник, имеющая примерный диаметр 10 мкм, должна подвергнуться по крайней мере тридцати популяционным удвоениям для образования 109 клеток с массой около 1 г. Для первично-локализованных (но не для первично-системных, возникающих в кроветворной системе) новообразований такие показатели характеризуют наименьшую, клинически распознаваемую опухолевую массу. Далее нужно лишь около 10 циклов удвоения, чтобы достичь количества 1012 клеток с массой примерно I кг. Это максимальный объем злокачественной опухоли, еще совместимый с жизнью. Приведенные подсчеты основаны на допущении, что все без исключения потомки трансформированной клетки сохраняют способность к делению и что в репликационном пуле (фонде воспроизведения) нет потери клеток. Подобный взгляд на развитие опухоли не совсем точен. Тем не менее приведенные подсчеты показывают важность того обстоятельства, что к моменту клинического обнаружения сформированного новообразования его клетки завершают наибольшую часть своего жизненного цикла. Это является главным препятствием при консервативном лечении злокачественных опухолей.
Клеточный цикл в опухолевой ткани насчитывает те же 5 фаз, что и в норме (G0 , G,, S, G2 и М; см. главу 6). Вопреки иллюзорному представлению о большой скорости деления малигнизированных клеток современные данные говорят о том, что общая продолжительность их клеточного цикла равна периоду нормального цикла или даже его превышает. Таким образом, рост опухолей не связан с укорочением клеточного цикла.
Часть клеток малигнизированной популяции, находящихся в пролиферативном пуле, относится к фракции роста. В ранних стадиях опухолевого роста подавляющее большинство трансформированных клеток состоит в пролиферативном пуле. По мере роста новообразования клетки во все большем количестве покидают этот пул из-за слущивания, недостаточного снабжения, перехода во фракцию дифференцировки или возвращения к фазе G0. Действительно, большинство клеток в злокачественном узле остается в фазах G0 и G,. Поэтому ко времени клинического обнаружения узла большинство его клеток уже не состоит в репликационном пуле. Известно, что даже в быстрорастущих опухолях фракция роста не превышает 20 \% от общего числа малигнизированных клеток.
Темп роста злокачественных новообразований определяется преобладанием воспроизведения клеток над их потерей. В некоторых случаях это преобладание велико и приводит к быстрому увеличению узла, в других — весьма незначительно.
Темп роста новообразования зависит от величины фракции роста и преобладания воспроизведения клеток над их потерей. При некоторых лейкемиях, лимфомах и мелкоклеточных карциномах легкого фракция роста довольно велика, и это обусловливает быстрое клиническое течение таких новообразований. Многие распространенные опухоли, например рак кишки и молочной железы, имеют небольшие фракции роста, и воспроизведение клеток превышает их потерю примерно на 10 \%. Такие карциномы имеют тенденцию к гораздо более медленному росту.
От фракции роста опухолевых клеток зависит чувствительность клеток новообразования к химиотерапии. Поскольку большинство противораковых препаратов действует на клетки, активно синтезирующие ДНК, нетрудно себе представить, что медленно растущие опухоли относительно устойчивы к лечению теми препаратами, которые уничтожают только делящиеся клетки. И, напротив, агрессивные опухоли (некоторые виды лимфом и др.), имеющие большой пул делящихся клеток, хорошо поддаются химиотерапии.
Морфологическим выражением темпа роста новообразования является частота митозов. Ее можно оценить по количеству фигур митоза в единице площади гистологического среза опухолевой ткани, а также с помощью проточной цитометрии (см. главу 1) или других методик. Если продолжительность клеточного цикла увеличена, то в любой момент исследования обнаруживается повышенное количество митозов, однако для оценки скорости роста опухоли нужно использовать такие показатели, как величина фракции роста и темп клеточной потери.
Ко времени обнаружения злокачественные опухоли человека проходят наибольшую часть своей биологической жизни в организме. С момента клинического обнаружения средний период удвоения объема опухоли для таких распространенных форм, как карциномы легкого и толстой кишки, длится от 2 до
З мес. В то же время для других форм рака этот период может продолжаться как менее одного месяца (некоторые опухоли у детей), так и более одного года (некоторые опухоли слюнных желез).
Опухолевый ангиогенез. Кроме механизмов цитокинетики, на темп роста новообразования влияет и ряд других факторов. В начале 70-х годов Фолкмен (J.Folkman) показал, что в культуре ткани (in vitro), т.е. без васкуляризации, опухолевые клетки могут расти только до узелков диаметром 1—2 мм. Но, когда такие узелки имплантируют в живые ткани (in vivo), то при наличии кровоснабжения из окружающих тканей по капиллярам, врастающим в опухоль, новообразование продолжает расти.
В опухолях солидного строения часто возникает некроз. Показано, что участок некроза внутри опухоли нередко образуется параллельно кровеносному сосуду и отделяется от него полосой в 1—2 мм жизнеспособных малигнизированных клеток. Эта зона в 1—2 мм вокруг сосуда предположительно представляет собой максимальную дистанцию, на величину которой могут легко распространяться вне сосуда кислород и другие питательные материалы из кровотока. Ангиогенез также крайне необходим для диссеминации опухолевых клеток, так как проникновение этих клеток в новообразованные сосуды происходит гораздо легче, чем в предсуществующие сосуды. Изучение меланом, рака молочной железы и толстой кишки показало полную зависимость метастазирования от выраженности ангиогенеза.
Опухоли содержат факторы, воздействующие на формирование новых капилляров. Факторы ангиогенеза вырабатываются опухолевыми клетками или клетками воспалительного ответа, например, макрофагами, инфильтрирующими новообразование. Выделено большое количество факторов ангиогенеза, связанных с ростом опухолей. Хорошо известно семейство гепа-ринсвязывающих факторов роста фибробластов (ФРФ). Эти молекулы обладают триадой функций: обеспечивают хемотаксис (передвижение) и митогенные стимулы для клеток эндотелия, а также вызывают продукцию протеолитических ферментов. Действие протеолитических ферментов облегчает проникновение эндотелиальных клеток в строму опухоли и органа. Другие факторы ангиогенеза, производные опухолевой паренхимы, включают ТФРа и -р, ЭФР и ТцФР. Не все из указанных факторов действуют непосредственно на эндотелий. Например, ТфРр тормозит рост эндотелиальных клеток in vitro, но является анги-огенным фактором in vivo. Он является хемоаттрактантом для макрофагов, которые продуцируют дополнительные факторы, такие как ФРФ и ФНОа.
Опухолевая прогрессия и гетерогенность. В ходе своего развития многие новообразования становятся все более агрессивными и увеличивают потенциал злокачественности. В ряде случаев, например при развитии рака толстой кишки, используя серийные биоптаты, можно проследить ход прогрессии от пред-опухолевых состояний до доброкачественных и, наконец, злокачественных новообразований. Поэтому под прогрессией понимают изменение совокупности признаков опухоли (генотипа, кариотипа и фенотипа опухолевых клеток, включающего различные черты их морфологической, биохимической и иной дифференцировки) в направлении все большего усиления злокачественности. Увеличение злокачественности связано с последовательным появлением клеточных субпопуляций, имеющих генои феноти-пические отличия от своих предшественников, которые представлены такими свойствами и признаками, как инвазивность, изменение темпа роста, способность к метастазированию, появление нового кариотипа, другой чувствительности к гормонам и противоопухолевым препаратам. Поэтому, несмотря на то, что первоначально большинство злокачественных новообразований имеет моноклональное происхождение, ко времени их клинического обнаружения клетки, составляющие их паренхиму, отличаются выраженной гетерогенностью, т.е. неоднородностью в генои фенотипическом отношении.
На молекулярном уровне опухолевая прогрессия и связанная с ней гетерогенность являются результатом множественных мутаций, накапливающихся в разных клетках. Последние дают начало новым субклонам с новыми признаками. Эти признаки варьируют в пределах одного эпидермального, энтеродермального или другого гистиотипа. Считают, что трансформированные клетки становятся генетически нестабильными, т.е. в высокой степени подверженными случайным, спонтанным мутациям в ходе распространения субклонов (схема 7.2). Кроме того, мутации определенных контрольных генов, например FCC, гена наследственного рака толстой кишки, могут предрасполагать к выраженной генетической нестабильности. Некоторые из таких мутаций могут быть летальными и приводят к выпадению субклона, другие стимулируют рост, действуя на протоонкогены или канцеросупрессорные гены. Например, мутации гена-суп-рессора р53 вызывают деление клеток с поврежденной ДНК, что делает возможным накопление в них дополнительных мутаций.
Все эти механизмы приводят к формированию субклонов, подвергающихся иммунному и неиммунному отбору. Например, клетки с особенно высокой концентрацией опухолевых антигенов подавляются и разрушаются защитными силами организма, в то время как другие, имеющие сниженную потребность в факторах роста, успешно проходят отбор. Таким образом, растущая опухоль стремится к обогащению такими субклонами, которые помогают ей победить в конкурентных межклеточных отношениях. В этом смысле внутриопухолевая селекция имеет адаптационный характер, так как проявляется в отборе клеток, наиболее приспособленных к выживанию, росту, инва-
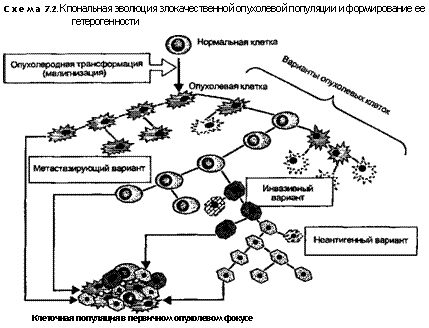 зии и метастазированию. Конечно, генетическая нестабильность, гетерогенность и отбор имеют место еще задолго до клинического обнаружения опухоли.
зии и метастазированию. Конечно, генетическая нестабильность, гетерогенность и отбор имеют место еще задолго до клинического обнаружения опухоли.
Темп, с которым формируются мутантные субклоны, весьма различен. Так, у больных с остеосаркомой во время их первого обращения к врачу уже обнаруживаются субклоны, способные к метастазированию. При других злокачественных новообразованиях, например слюнных желез, агрессивные субклоны формируются медленно и редко.
Механизмы инвазии и метастазирования. Прорастание окружающих тканей и дистантное распространение по лимфатическим и кровеносным сосудам — главные отличительные признаки злокачественного роста. Чаще всего они и являются причиной смерти больных. Для того чтобы опухолевые клетки освободились из первичного узла, затем проникли в лимфатическое или кровеносное русло и начали вторичный рост в каком-либо другом месте, им нужно пройти ряд ступеней так называемого метастатического каскада. На каждой ступени эти клетки подвергаются множеству различных воздействий и могут погибнуть (схема 7.3).
Малигнизированные клетки внутри первичного узла обладают гетерогенностью не только сами по себе, но и в отношении потенции к метастазированию. Лишь некоторые субклоны об-
іг. Пальцев, т. 1.
321
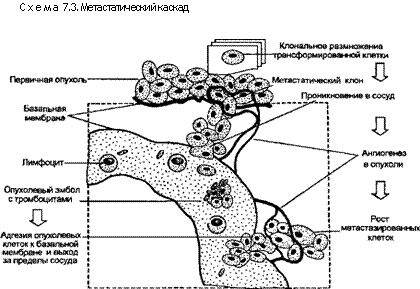 ладают той комбинацией генных продуктов, которая необходима для прохождения всех ступеней метастатического каскада. Различают две фазы метастатического каскада: инвазию во внеклеточный матрикс и сосудистую диссеминацию с последующим расселением опухолевых клеток в тканях.
ладают той комбинацией генных продуктов, которая необходима для прохождения всех ступеней метастатического каскада. Различают две фазы метастатического каскада: инвазию во внеклеточный матрикс и сосудистую диссеминацию с последующим расселением опухолевых клеток в тканях.
Инвазия во внеклеточный матрикс. Составные части тканей организма человека разделены двумя типами внеклеточного матрикса: базальными мембранами и стромаль-ной соединительной тканью. Несмотря на различную организацию этих типов внеклеточного матрикса, каждый из них построен из коллагенов, гликопротеинов и протеогликанов (см. главу 2). В ходе продвижения опухолевые клетки взаимодействуют с внеклеточным матриксом на различных ступенях метастатического каскада. Так, раковая клетка вначале утрачивает прикрепление к соседним раковым или немалигнизированным эпителиоцитам (рис. 7.29, 7.30, 7.31), а затем проникает сквозь базальную мембрану эпителия (рис. 7.32), потом преодолевает стромальную ткань и далее проникает в сосуд через его базальную мембрану. Характерная очередность метастазирования карцином — вначале лимфогенного, затем гематогенного — объясняется, видимо, еще двумя обстоятельствами: более близким расположением к эпителию именно лимфатических, а не кровеносных капилляров, а также отсутствием в лимфатических капиллярах базальной мембраны.
Две последние ступени метастатического каскада (а иногда и все три, при метастазировании в эпителиальные комплексы)
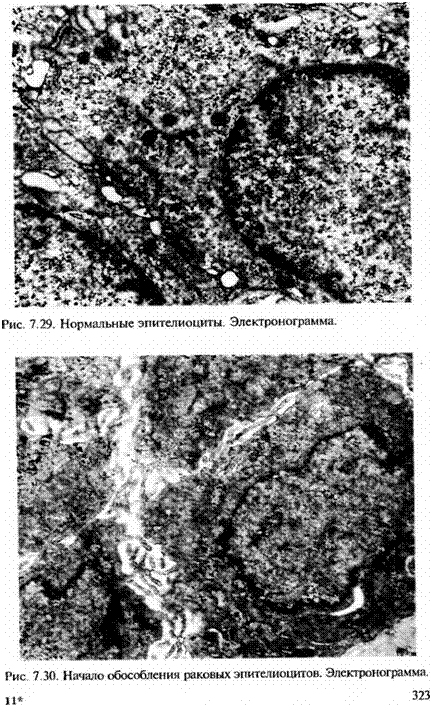
Рис. 7.31. Разъединение малигнизированных клеток. Электронограмма
клетки опухоли в обратном порядке проходят в местах, удаленных от первичного опухолевого узла. Инвазию во внеклеточном матриксе можно в свою очередь разделить на 4 ступени: разъединение или освобождение малигнизированных клеток, прикрепление к компонентам матрикса, расщепление внеклеточного матрикса, миграция опухолевых клеток (см. схема 7.3).
Нормальные клетки прикреплены друг к другу или к компонентам микроокружения с помощью молекул адгезии (см. главу 2). Среди этих молекул важное значение имеет семейство кадге-ринов, относящееся к трансмембранным гликопротеидам. Эпителиальные кадгерины обеспечивают адгезию эпителиоцитов, способствуя формированию пласта или тканевого комплекса. В то же время в карциномах (молочной железы, толстой кишки и др.) регуляция экспрессии эпителиальных кадгеринов заметно ослаблена, что приводит к снижению способности клеток к взаимному прикреплению и облегчает их освобождение из первичного опухолевого узла.
Для проникновения через окружающий внеклеточный матрикс малигнизированные клетки вначале должны прикрепиться к его компонентам. Доказано, что опосредованное рецепторами прикрепление опухолевых клеток к ламинину и фибронектину определяет дальнейший ход инвазии и метастазирования. Нормальный эпителий экспрессирует для ламинина базальной мемРис 7.32. Раковый эпителиоцит начинает инвазивный процесс с очагового лизиса базальной мембраны в местах «вдавлення» цитоплазмы. Электронограмма.
браны родственные интегриновые рецепторы, собранные на базальной поверхности эпителиоцитов. В отличие от последних, раковые клетки имеют гораздо больше рецепторов, распределенных по их цитолемме. Обнаружено соответствие между высокой плотностью распределения рецепторов прикрепления (в карциномах молочной железы и кишки) и способностью их носителей — раковых клеток — к инвазии. Кроме того, малигнизированные клетки экспрессируют также интегрины, которые являются рецепторами для многих компонентов внеклеточного матрикса, включая фиб-ронектин, ламинин, коллагены и витронектин (по R.S.Cotran, K.Kumar, T.Collins, 1998). Известна связь между экспрессией ин-тегрина щ—р, (VLA-4) на клетках меланомы и их способностью к метастазированию. Однако такая связь не универсальна, и, вероятно, опухолевые клетки используют разные механизмы для прикрепления к внеклеточному матриксу.
После прикрепления к компонентам базальной мембраны или интерстициального внеклеточного матрикса малигнизированные клетки прокладывают себе пути для миграции. Инвазия в матрикс не обеспечивается исключительно за счет пассивного роста, она требует активного ферментного расщепления компонентов внеклеточного матрикса. Опухолевые клетки могут сами вырабатывать протеолитические ферменты либо индуцировать продукцию протеаз местными клетками, например, стромаль-ными фибробластами или макрофагами иммунного инфильтрата. Идентифицированы 3 класса протеаз: сериновые, цистеино-вые и металлопротеиназы. Известно, что коллагеназа IV типа является металлопротеиназой, расщепляющей коллаген IV типа базальных мембран эпителия и сосудистой стенки. Получены доказательства важной роли, которую выполняет эта коллагеназа на ранних этапах опухолевой инвазии. Большое значение при расщеплении внеклеточного матрикса имеют также катепсин D (цистеиновая протеиназа) и активатор плазминогена — уроки-наза (сериновая протеиназа). Эти ферменты воздействуют на широкий набор субстратов, включая фибронектин, ламинин и белковые стержни протеогликанов. Их уровни содержания в плазме повышены при многих злокачественных новообразованиях. А уровни катепсина D имеют даже прогностическое значение для больных раком молочной железы. Показано, что у лиц с повышенными уровнями указанных ферментов в плазме обнаруживаются более развитые стадии инвазии по сравнению с носителями таких же опухолей, но имеющими низкие уровни ферментов.
На следующей ступени инвазии происходит продвижение малигнизированных клеток через расщепленные структуры базальных мембран и зоны протеолиза в матриксе. Миграция опосредована цитокинами, продуцируемыми опухолевыми клетками, один из которых называется фактором самопроизвольной подвижности. Это белок с молекулярной массой в 55 килодальтон, вызывающий подвижность клеток путем связывания со специфическим рецептором. Кроме того, активация хемотаксиса для малигнизированных клеток обеспечивается еще и продуктами расщепления компонентов матрикса (коллагена, ламинина и др.), а также некоторыми факторами роста — инсулиноподобными факторами роста (ИПФР)-1 и 2. Последние принимают участие в процессах селективного расселения опухолевых клеток во внутренних органах и тканях.
Конечно, наиболее очевидным следствием деструкции матрикса является создание путей или каналов для инвазии клеток злокачественных новообразований. Кроме того, продукты расщепления различных компонентов матрикса, в частности коллагена и протеогликанов, обладают активностью, стимулирующей рост клеток, а также ангиогенез и хемотаксис.
Сосудистая диссеминация и расселение опухолевых клеток. При циркуляции в кровотоке опухолевые клетки бывают весьма чувствительны к разрушающему воздействию естественных и адаптационных иммунных сил. В контроле над гематогенным распространением злокачественных новообразований большую роль играют лимфоциты, относящиеся к классу NK-клеток (см. главу 5).
В ходе циркуляции опухолевые клетки склонны к агрегации в группы. Этот процесс облегчен благодаря механизму гомотопических адгезии (прикрепления друг к другу родственных элементов) между этими клетками и механизму гетеротипических адгезии между малигнизированными клетками и элементами крови, в частности тромбоцитами. Формирование тромбоцитарно-опухо-левых агрегатов увеличивает шансы малигнизированных клеток на выживание и последующую имплантацию (вживление) в новую для них ткань. Затем происходит задержка опухолевого эм-бола в месте его прикрепления к эндотелию и проникновение клеток этого эмбола за пределы базальной мембраны в экстрава-зальные ткани. В этих процессах участвуют молекулы адгезии (интегрины, селектины) и протеолитические ферменты.
Особый интерес представляет молекула адгезии CD44, экс-прессированная на нормальных Т-лимфоцитах и используемая ими для миграции в некоторые участки лимфоидной ткани. Эта миграция выполняется с помощью связывания CD44 с высоким эндотелием посткапиллярных венул. В некоторых злокачественных новообразованиях экспрессируются различные формы CD44, которые могут быть использованы для имплантации опухолевых клеток в лимфатические узлы. Показана также связь между объемом лимфогенного метастазирования и высокими уровнями экспрессии CD44 на малигнизированных клетках.
Места, в которых опухолевые клетки покидают капилляры при метастазировании, связаны с анатомической локализацией первичной опухоли. Однако расположение естественных дренажных путей не может полностью объяснить варианты распределения метастазов. Например, рак простаты метастазирует преимущественно в кости, бронхогенная карцинома — в надпочечники и головной мозг, нейробластома — в печень и кости.
Первая ступень в экстравазальном распространении опухолевых клеток состоит в их прикреплении к эндотелию. Опухолевые клетки могут экспрессировать молекулы адгезии, лиганды которых представлены на эндотелиальных клетках органа-мишени. Кроме того, известно, что в лимфатических сосудах наиболее частым местом прикрепления являются створки клапанов лимфанги-онов (специфических клапанно-сократительных сегментов). По мере внутрисосудистого роста раковых клеток развивается атрофия миоцитов и клапанного аппарата лимфангиона. Все это приводит к ослаблению, а затем и к местной блокаде лимфотока. Блокада, а также ангиогенез, обеспечиваемый раковыми клетками, стимулируют развитие коллатеральных путей лимфотока — развивается метастатическое поражение лимфатических узлов, в том числе не региональных для органа-носителя опухоли. Кроме лимфатических капилляров и сосудов, в распространении малигнизированных клеток активно участвует венозная сеть. Некоторые органы-мишени выделяют хемоаттрактанты, привлекающие к этим органам малигнизированные клетки. К ним относятся некоторые цитокины — ИПФР-1 и -2, вырабатываемые в разных тканях. В ряде случаев образованию колонии опухолевых клеток могут препятствовать ингибиторы протеаз.
Таким образом, несмотря на то, что распространение злокачественных новообразований имеет определенные закономерности, предвидеть точную локализацию будущих метастазов в каждом отдельном случае невозможно.
Молекулярные основы метастазирования. До сих пор какой-либо единый ген метастазирования не обнаружен. В то же время трансфекция клеток с мутантным геном ras обеспечивает не только автономный рост, но и другие изменения, дающие клеткам потенции к метастазированию. Кроме того, отмечены одновременно индукция ферментов расщепления (металлопротеиназ) и снижение экспрессии их тканевых ингибиторов. Молекулярные основы такого плейотропного действия еще не известны (плейотропия — влияние одного гена на несколько фенотипических признаков).
Когда нормальные клетки сливают in vitro с опухолевыми клетками метастазирующей линии, некоторые такие гибриды сохраняют опухолевые, но теряют метастазогенные свойства. Все это заставляет предположить наличие у некоторых нормальных генов способности к подавлению одного или нескольких метастазогенных свойств. Недавно были выявлены несколько кандидатов на роль генов, подавляющих метастазирование, с помощью метода вычитаемой гибридизации библиотеки генома (библиотека — набор клонированных фрагментов ДНК, содержащий весь геном). Один из таких генов, названный nm23 (поп-metastatic), привлек наибольшее внимание. В эксперименте было показано, что его экспрессия высока у тех линий лабораторных мышей, которые имеют низкий метастазогенный потенциал и, наоборот, она в десятки раз ниже у линий с высокой способностью к метастазированию. У женщин-носителей карциномы молочной железы с метастазами в 1—3 региональных лимфатических узлах уровни экспрессии nm23 очень высокие, но при обширном лимфогенном метастазировании они стабильно низкие. Возможность экстраполяции этих данных на другие новообразования изучается. Возможно, nm23 подавляет метастатический процесс только в каких-то специфических тканях, например, в эпителии молочной железы, но не толстой кишки.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
