Страница 47
Липиды
1-5
Углеводы
0,2-2
В теле человека вода составляет 60%, из которой 40% приходится на внутриклеточную, а 20% — на экстраклеточную воду. Плазма крови содержит 5% экстраклеточной воды (рис. 56).
Вода имеет исключительно важное значение для жизнедеятельности клеток, представляя собой среду, в которой осуществляются важнейшие реакции, лежащие в основе синтеза и распада веществ. Кроме того она является растворителем различных химических веществ. Вещества, хорошо растворимые в воде получили название гидрофильных (от греч. hydros — вода, phileo — люблю),  плохо растворимые называют гидрофобными (от греч. hydrosвода, phobos — боязнь). В воде хорошо растворяются хлористый натрий, сахара, простые спирты, альдегиды, кетоны. Под влиянием растворенных веществ вода может изменять свои свойства, в частности, могут изменяться температура замерзания, температура кипения, давление пара и осмотическое давление воды. Эта особенность воды имеет очень важное биологическое значение. Например, рыбы в пресной воде при температуре ее замерзания сохраняют свою активность, причем по той причине, что концентрация веществ, растворенных в крови рыб, является большей, чем в воде, и это исключает переохлаждение, а затем и замерзание их крови.
плохо растворимые называют гидрофобными (от греч. hydrosвода, phobos — боязнь). В воде хорошо растворяются хлористый натрий, сахара, простые спирты, альдегиды, кетоны. Под влиянием растворенных веществ вода может изменять свои свойства, в частности, могут изменяться температура замерзания, температура кипения, давление пара и осмотическое давление воды. Эта особенность воды имеет очень важное биологическое значение. Например, рыбы в пресной воде при температуре ее замерзания сохраняют свою активность, причем по той причине, что концентрация веществ, растворенных в крови рыб, является большей, чем в воде, и это исключает переохлаждение, а затем и замерзание их крови.
Для воды характерно то, что она обладает некоторой способностью к обратимой ионизации, в ходе которой она распадается на ионы водорода (Н+) и ионы гидроксила (ОН-).
Для изменения концентрации ионов Н+ в любом водном растворе используют так называемую шкалу рН, с помощью которой обозначают концентрацию водородных ионов (Н+) в водных растворах, кислотность которых находится между 1,0 МН+ и 1,0 МОН-. Так значение рН для нейтрального раствора составляет 7,0, тогда как растворы, имеющие рН выше 7,0, — это щелочные растворы, а меньше 7,0 — это кислые растворы. Например, рН питьевой воды составляет 9,0, нашатырного спирта — 12,0, черного кофе — 5,0 лимонного сока — 2,0, а желудочного сока — 1,0. Величины рН характерны для всех внутриклеточных и внеклеточных жидкостей в организме, причем постоянство концентрации водородных ионов поддерживается буферными системами, которые у млекопитающих представлены фосфатной и бикарбонатной системами. Величины рН всех жидкостей организмов исключительно постоянны. Их изменения чрезвычайно неблагоприятны для организмов, поскольку даже небольшие сдвиги рН характеризуются значительным падением каталитической активности ферментов.
В воде под влиянием ферментов происходят реакции гидролиза (от греч. hydros — вода, lysis — расщепление) белков и других соединений. Вода принимает участие также в выведении из клеток продуктов обмена. Наконец, она поддерживает тепловой режим клетки.
Минеральные соли входят в состав цитоплазмы. Встречаются калиевые, натриевые, магниевые соли, соли серной, соляной, фосфорной и других кислот. Важнейшая роль минеральных солей заключается в определении ими кислотно-щелочного состояния протоплазмы. Они необходимы также для размножения клеток.
Органическими (углеродсодержащими) соединениями клетки являются белки, нуклеиновые кислоты, углеводы, липиды и АТФ. Как уже отмечено, молекулы этих соединений часто называют биологическими молекулами, а из-за их крупных размеров — макромолекулами.
Поскольку все органические соединения клетки содержат углерод, то принято считать, что жизнь на Земле построена на углеродистой основе. Замечательной особенностью углерода является то, что его атомы очень легко образуют ковалентные связи с другими атомами, в результате чего он больше других элементов способен образовывать большие молекулы. До некоторой степени такой способностью, но меньшей, обладает и кремний, что явилось основанием к известным предположениям о существовании жизни на других планетах, но на кремниевой основе.
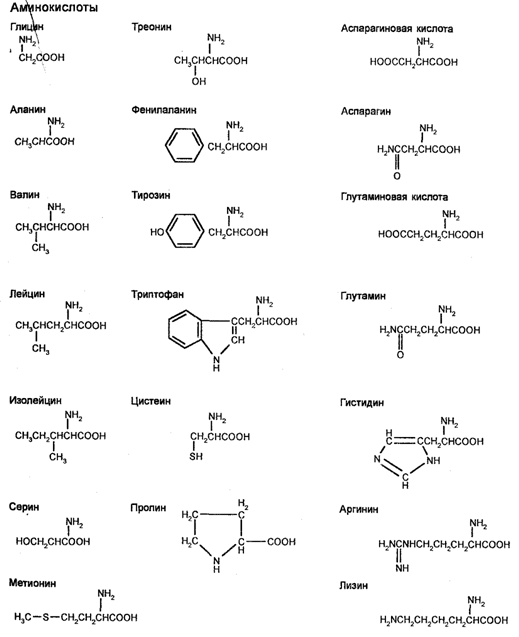
Белки, или, как их еще называют, протеины (от греч. protos — первостепенный), являются наиболее сложными химическими соединениями, характеризующимися большой молекулярной массой. В состав всех известных белков входят углерод, водород, азот и кислород. В большинстве белков находят серу, а в некоторых белках — фосфор, железо, цинк и медь. Будучи макромолекулами, они представляют собой линейные полимеры, в которых мономерами являются аминокислоты, каждая из которых состоит из аминогруппы (-NH2), карбоксильной группы (-СООН), атома водорода и R-группы, присоединенной к атому углерода, который называют tt-углеродным атомом. Благодаря наличию аминогрупп и карбоксильных групп аминокислоты способны реагировать друг с другом и образовывать между собой ковалентные связи. В частности, аминокислоты соединяются одна с другой посредством соединения аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Возникающую между аминокислотами связь называют пептидной (амидной), а несколько соединений аминокислот называют пептидом. Т.к. первоначально образующийся дипептид содержит реакционноспособные аминогруппу и карбоксильную группы, то к нему способны присоединиться другие аминокислоты, образуя полипептид (белок). Обычно цепь из трех аминокислот называют трипептидом, а цепь из многих соединенных аминокислот называют полипептидной цепью. Следовательно, пептиды — это цепочки аминокислот. Белок может состоять из одной полипептидной цепи или нескольких. Например, миоглобин состоит из одной цепи, тогда как гемоглобин — из двух цепей одного типа и двух цепей другого типа.
Для полипептидных цепей характерна неразветвленная структура. Молекула белка представляет собой, по существу, неопределенно длинные цепи аминокислот, связанные пептидными связями:
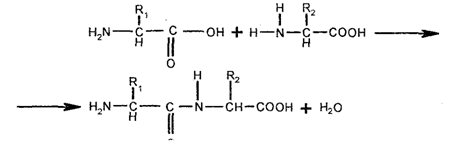
где R-группы (боковые группы, цепи) являются радикалами, каждый из которых состоит из гидроксильной (ОН-), сульфгидриль-ной (SH-) и других групп и которые являются частью молекулы. Боковые R-группы, будучи разными по структуре, электрозаряду и растворимости в воде, определяют различия между аминокислотами.
Для аминокислот характерна ассиметричность, в результате чего различают Lи D-аминокислоты. В составе клеточных белков имеются только L-аминокислоты, известно 20 L-аминокислот. Эти аминокислоты часто называют стандартными (основными, нормальными), т. к. известны и еще другие аминокислоты, которые присутствуют в организмах, но не обнаруживаются в большинстве их белков. Такие нестандартные аминокислоты встречаются в коллагене (4-гидроксипролин и 5-гидроксилизин), миозине (N-метил-лизин), в протромбине (g-карбоксиглутаминовая кислота) и в эластине (десмозин). Предполагают, что L-аминокислоты существуют около 2 млрд лет. Из них построены белки всех известных к настоящему времени организмов. Различия между разными L-аминокис-лотами определяются боковыми R-группами, присоединенными к альфауглероду. Кроме пептидов, образующих белки, существует много пептидов, встречающихся в организмах животных и человека в виде свободных соединений, не связанных с белками. Такими пеп-тида^яи являются некоторые гормоны (инсулин, глюкагон и другие). Поскольку R-группы характеризуются разной степенью полярности (разной способностью взаимодействовать с водой при рН около 7,0), то аминокислоты классифицируют на аминокислоты, содержащие неполярные R-группы (аланин, валин, лейцин, изолейцин, пролин), полярные незаряженные R-группы (глицин, серии, треонин, цисте-ин, тирозин, аспарагин, глутамин), отрицательно заряженные (кислые) R-группы (аспарагиновая и глутаминовая кислоты), положительно заряженные (основные) R-группы (лизин, аргинин, гистидин).
Обсуждение Биология с основами Экологии
Комментарии, рецензии и отзывы
