4.7. общие проявления воспаления
4.7. общие проявления воспаления
Лихорадка (повышение температуры тела) — наиболее распространенное системное проявление острого воспаления, особенно когда оно обширно и вызвано инфекцией. В острую фазу лихорадочной реакции наблюдаются различные системные проявления, в том числе удлинение медленно-волновой фазы сна, снижение аппетита, усиление разрушения белков, гипотензия и другие гемодинамические нарушения, синтез печенью белков острой фазы, сывороточного амилоида А, комплемента и белков системы свертывания крови, а также различные изменения лейкоцитов в периферической крови. Лихорадка развивается вследствие взаимодействия цитокинов, выделенных лейкоцитами и другими клетками, с сосудистыми рецепторами в центре терморегуляции гипоталамуса. Путем прямого воздействия или благодаря местной продукции простагландинов цитокины передают информацию из переднего гипоталамуса через задний в сосудо-двигательный центр, что приводит к стимуляции симпатических нервов, спазму сосудов кожи, снижению сердечного выброса и лихорадке.
Лейкоцитоз. Это общее проявление воспалительных реакций, особенно вызванных бактериальной инфекцией. Обычно количество лейкоцитов возрастает до 15,0—20,0 109/л, но иногда может достигать необычайно высоких цифр — 40,0—100,0-109/л. Такое увеличение расценивается как лейкемоидная реакция, так как она напоминает лейкемию. Первоначально лейкоцитоз возникает из-за усиленного выхода клеток из постмитотическо-го резервного пула костного мозга и связан с увеличением количества незрелых нейтрофилов в крови. Большинство бактериальных инфекций вызывает нейтрофилию, однако инфекционный мононуклеоз, свинка, корь являются исключениями; при этих заболеваниях лейкоцитоз возникает за счет абсолютного увеличения количества лимфоцитов (лимфоцитоз). Имеется также группа заболеваний, включающая бронхиальную астму, сенную лихорадку и паразитарные инфекции, при которых происходит абсолютное увеличение количества эозинофилов (эози-нофилия).
Некоторые инфекции (брюшной тиф и инфекции, вызванные вирусами, риккетсиями и некоторыми простейшими) сопровождаются уменьшением количества циркулирующих лейкоцитов {лейкопения). Лейкопения развивается также при инфекциях у ослабленных больных, страдающих распространенным раком или прогрессирующим туберкулезом.
6. Пальцев, т. 1.
161
4.8. Репарация, регенерация и заживление ран
После нейтрализации повреждающих факторов начинается восстановление поврежденной ткани. В процессе заживления поврежденная ткань восстанавливается в результате регенерации паренхиматозных клеток или замещается путем заполнения дефекта соединительной тканью (рубцевание), или вследствие комбинации этих двух процессов. Различают 4 компонента процесса заживления: 1) новообразование кровеносных сосудов (ангиогенез); 2) миграцию и пролиферацию фибробластов; 3) продукцию внеклеточного матрикса; 4) созревание и организацию соединительной ткани.
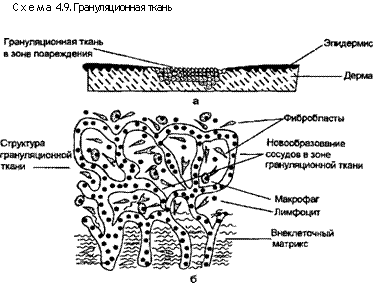 |
литическое разрушение базальной мембраны сосудов с образованием капиллярных отростков и одновременной миграцией клеток; 2) миграцию эндотелиальных клеток в направлении ан-гиогенного стимула; 3) пролиферацию эндотелиальных клеток сразу после миграции клеток; 4) созревание эндотелиальных клеток и их организацию в капиллярные трубки. Вновь образованные сосуды имеют проницаемые межэндотелиальные контакты, допускающие выход белков и эритроцитов из сосудистого русла. Поэтому грануляционная ткань нередко бывает отечной.
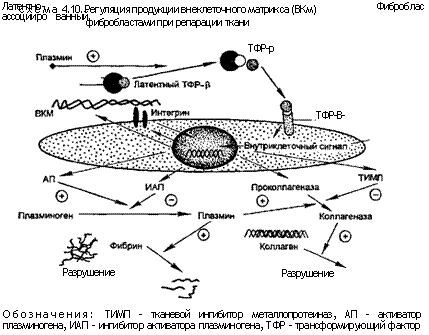
Некоторые факторы могут стимулировать ангиогенез, в том числе основной фактор роста фибробластов и фактор роста эндотелия сосудов. Основной фактор роста фибробластов выделяется активированными макрофагами и может влиять на любые этапы ангиогенеза. Фактор роста эндотелия сосудов продуцируют опухолевые клетки; он вызывает как ангиогенез, так и повышение проницаемости сосудов (влияет на опухолевый ангиогенез и рост кровеносных сосудов в норме), а также участвует в хроническом воспалении и заживлении ран. Миграцию фибробластов к месту повреждения и их одновременную пролиферацию вызывают факторы роста и фиброгенные цитокины, которые образуются в макрофагах. Некоторые из этих факторов роста стимулируют синтез коллагена и других молекул соединительной ткани, а также модулируют синтез и активацию метал-лопротеиназ и ферментов, участвующих в разрушении компонентов внеклеточного матрикса (схема 4.10).
Заживление ран. Классическим примером заживления ран является заживление чистых, неинфицированных хирургических разрезов, соединенных с помощью хирургического шва. Такое заживление называют первичным соединением, или заживлением первичным натяжением. Разрез вызывает гибель ограниченного количества эпителиальных и соединительнотканных клеток и нарушение целости эпителиальной базальной мембраны. Узкое пространство разреза сразу заполняется свертками крови, содержащими фибрин и клетки крови; дегидратация поверхности свертка крови приводит к образованию струпа, закрывающего рану.
Через 24 ч в краях разреза появляются нейтрофилы, которые продвигаются к фибриновому сгустку. Эпидермис по краям разреза утолщается в результате митотической активности базального слоя кератиноцитов и фибробластов, и через 24—48 ч тяжи из эпителиальных клеток как мигрирующие, так и растущие вдоль краев разреза дермы образуют по мере движения компоненты базальной мембраны. Они сливаются посередине поверхности струпа, формируя таким образом непрерывный, но тонкий слой эпителия.
Через 3 дня нейтрофилы обычно заменяются макрофагами. Постепенно грануляционная ткань замещает пространство раз-
6*
163
 реза. Коллагеновые волокна имеются в краях разреза, однако вначале они ориентированы вертикально и не образуют мостиков через разрез. Продолжается пролиферация эпителиальных клеток, утолщается покрывающий слой эпидермиса.
реза. Коллагеновые волокна имеются в краях разреза, однако вначале они ориентированы вертикально и не образуют мостиков через разрез. Продолжается пролиферация эпителиальных клеток, утолщается покрывающий слой эпидермиса.
Через 5 дней пространство разреза заполняется грануляционной тканью. Новообразование сосудов достигает наибольшей интенсивности. Фибриллы коллагена становятся более многочисленными, начинается образование мостиков через разрез. Эпидермис достигает нормальной толщины, а диффе-ренцировка поверхностных клеток приближается к уровню архитектоники зрелого эпидермиса с поверхностной кератиниза-цией.
В течение 2-й недели продолжаются накопление коллагена и пролиферация фибробластов. Лейкоцитарный инфильтрат и отек обычно исчезают. В это время начинается продолжительный процесс побледнения рубцовой ткани, обусловленный накоплением коллагена в рубце и уменьшением васкуляризации.
В конце 1-го месяца рубец содержит ячеистую соединительную ткань, свободную от воспалительного инфильтрата и покрытую интактным эпидермисом. Придатки кожи, разрушенные вдоль разреза, полностью утрачиваются. Сила натяжения раны (контракция) увеличивается, но до полного заживления может потребоваться еще несколько месяцев.
Когда происходит значительная утрата клеток и тканей, например при инфаркте, изъязвлении, образовании абсцесса, а также поверхностных ранах с большими дефектами тканей, ре-паративные процессы затруднены. Основной проблемой во всех этих случаях является значительный дефект ткани, который должен быть замещен. Регенерация паренхиматозных клеток не может полностью восстановить оригинальную архитектонику. Обильная грануляционная ткань растет с краев, формируя рубец. Такое заживление ран называется заживлением вторичным соединением, или вторичным натяжением.
Вторичное заживление отличается от первичного следующими признаками:
1) значительные тканевые дефекты вначале заполняются
большим количеством фибрина и остатков некротизированных
тканей, а также экссудатом, которые должны быть удалены.
Следовательно, развивается более интенсивная воспалительная
реакция;
образуется значительно большее количество грануляционной ткани. Когда крупные дефекты имеются в более глубоких тканях, например в органах, формируется грануляционная ткань, которая утилизирует остатки разрушенной ткани, так как поверхностный дренаж отсутствует;
возможно, особенностью, которая позволяет легче всего отличить первичное заживление от вторичного, является феномен сжатия раны, который наблюдается при больших раневых поверхностях. Сжатие связывают с наличием миофиброблас-тов — измененных фибробластов, которые имеют ультраструктурные характеристики гладкомышечных тканей и экспрессиру-ют гладкомышечный актин (SMA), не характерный для типичных фибробластов.
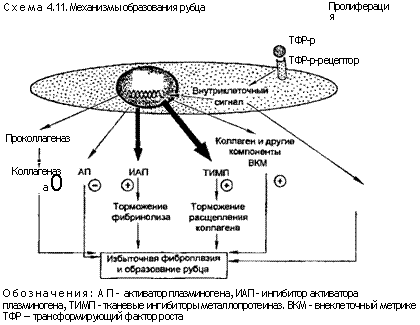
Таким образом, заживление ран является сложным феноменом, включающим острое воспаление, регенерацию паренхиматозных клеток, миграцию и пролиферацию как паренхиматозных, так и соединительнотканных клеток, синтез белков внеклеточного матрикса, перестройку соединительной ткани и паренхиматозных компонентов, а также коллагенизацию и натяжение раны. В основе большинства этих процессов лежат уже описанные механизмы: медиаторы острого воспаления, факторы роста и взаимодействие клеток с внеклеточным веществом в процессе миграции клеток, их пролиферации и дифференци-ровки, а также механизмы ангиогенеза и фиброза (схема 4.11).
Отложение соединительнотканного матрикса, особенно коллагена, его перестройка в рубец, возникновение феномена натяжения раны — основные этапы заживления ран.
Коллаген — наиболее распространенный в животном мире белок, формирующий опорную внеклеточную сеть для всех многоклеточных организмов. В настоящее время найдено 19
 различных типов коллагена. Интерстициальные фибриллярные коллагены I и III типов обеспечивают натяжение заживающих ран. Синтез коллагена фибробластами происходит в начале заживления ран, через 3—5 дней, и продолжается несколько недель, в зависимости от размеров раны. Синтез коллагена стимулируется факторами роста и цитокинами, которые секретируют-ся лейкоцитами и фибробластами в заживающей ране. Формирование коллагеновой сети, однако, зависит не только от синтеза, но и от разрушения коллагена и других компонентов внеклеточного матрикса.
различных типов коллагена. Интерстициальные фибриллярные коллагены I и III типов обеспечивают натяжение заживающих ран. Синтез коллагена фибробластами происходит в начале заживления ран, через 3—5 дней, и продолжается несколько недель, в зависимости от размеров раны. Синтез коллагена стимулируется факторами роста и цитокинами, которые секретируют-ся лейкоцитами и фибробластами в заживающей ране. Формирование коллагеновой сети, однако, зависит не только от синтеза, но и от разрушения коллагена и других компонентов внеклеточного матрикса.
Другими важными компонентами внеклеточного матрикса служит эластин — гидрофобный негликозилированный нерастворимый белок, центральным ядром которого является эластиновое волокно, а также ламинин, фибронектин и протеогликаны.
Разрушение коллагена и других белков внеклеточного матрикса обеспечивается семейством нейтральных протеаз — металлопротеиназ, для активации которых необходимы ионы цинка. Семейство металлопротеиназ включает интерстициальные коллагеназы, которые расщепляют фибриллярный коллаген I и III типов; желатиназы, разрушающие аморфный коллаген IV типа, а также фибронектин; стромелизины, действующие на различные компоненты внеклеточного матрикса, включая протеогликаны, ламинин, фибронектин и аморфные коллагены.
 Эти ферменты образуются несколькими типами клеток (фиб-робластами, макрофагами, нейтрофилами, синовиальными и некоторыми эпителиальными клетками), а их секреция стимулируется факторами роста и цитокинами. Некоторые цитокины подавляют активность металлопротеиназ, стимулируя синтез их тканевых ингибиторов.
Эти ферменты образуются несколькими типами клеток (фиб-робластами, макрофагами, нейтрофилами, синовиальными и некоторыми эпителиальными клетками), а их секреция стимулируется факторами роста и цитокинами. Некоторые цитокины подавляют активность металлопротеиназ, стимулируя синтез их тканевых ингибиторов.
Ремоделирование внеклеточного матрикса считается крайне важным процессом, поскольку индивидуальные компоненты внеклеточного матрикса усиливают или замедляют подвижность клеток, регулируют их активацию и дифференцировку.
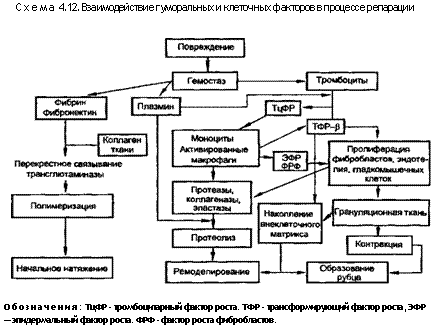
Таким образом, заживление ран является прототипом многих других форм восстановления ткани, динамичным и меняющимся процессом. Ранняя фаза — это воспаление, следующая стадия — фиброплазия, а затем перестройка ткани и рубцевание. Удивительно точная «режиссура» этих событий в норме связана со специфическими растворимыми медиаторами и их рецепторами на особых клетках, с клеточно-матриксными взаимодействиями и контролирующим действием физических факторов, включающих силы, генерирующие изменения размеров и пластичность клеток (схема 4.12).
Патологические аспекты воспаления и восстановления (регенерации). Многие системные и местные факторы в организме хозяина влияют на адекватность воспалительно-репаративного ответа. Исход последнего в первую очередь зависит от структуры ткани, в которой развивается это повреждение, природы повреждающего агента и иммунного статуса организма. На заживление ран оказывает влияние характер питания. Дефицит белка, например, и особенно дефицит витамина С тормозят синтез коллагена и замедляют заживление. Глюкокортикоиды обладают выраженным противовоспалительным действием, которое влияет на различные компоненты воспаления и фиброплазии. Наиболее важной причиной задержки заживления является инфекция. Механические факторы, такие как повышенное внут-рибрюшное давление, могут вызывать разрыв абдоминальных ран. Неадекватное кровоснабжение, обычно вызванное артериосклерозом или венозными аномалиями, ухудшает венозный дренаж и замедляет заживление. Наконец, инородные тела (остатки хирургического шовного материала, фрагменты металла, стекло и даже костные образования) влияют на заживление.
Инцизионные рубцы или травматические повреждения могут возникать вслед за обильной пролиферацией фибробластов и других соединительнотканных элементов, которые могут, фактически, повторить рубец. Так называемые десмоиды, или агрессивные фиброматозы, занимают промежуточное положение между доброкачественными пролиферациями и злокачественными опухолями (см. главу 25). Действительно, граница между доброкачественной гиперплазией, характерной для восстановления, и новообразованием часто бывает условной. Накопление больших количеств коллагена может привести к образованию опухолеподобного рубца, известного как келоид. Для образования келоида нужны индивидуальные предпосылки. Например, по неизвестным причинам он чаще образуется у людей, принадлежащих к африканской расе. Отклонением при заживлении ран является также образование избыточной грануляционной ткани, которая выдавливается на уровне окружающей кожи и фактически блокирует реэпителизацию. Этот процесс называют избыточной грануляцией, или образованием дикого мяса. Избыточные грануляции приходится удалять хирургическим путем, чтобы восстановить непрерывность эпителия.
Механизмы фиброплазии при заживлении ран — пролиферация клеток, межклеточные взаимодействия, клеточно-мат-риксные взаимосвязи и осаждение внеклеточного матрикса — похожи на те, которые отмечаются при фиброзе, сопровождающем хроническое воспаление (ревматоидный артрит, фиброз легких, цирроз печени). При заживлении ран, однако, фиброз связан с персистированием начальных стимулов для гиперплазии или развитием иммунных и аутоиммунных реакций, при которых лимфоцитарно-моноцитарные взаимодействия поддерживают синтез и секрецию факторов роста и фиброгенных ци-токинов, протеолитических ферментов и других биологически активных молекул. Разрушение коллагена коллагеназой, напри-
мер, которое играет важную роль в нормальном заживлении ран, вызывает тяжелые повреждения суставов при ревматоидном артрите.
Образующийся рубец сам по себе в зависимости от его величины и расположения может вызывать постоянную дисфункцию, например при рубцевании инфаркта миокарда. В этом случае соединительная ткань не только приводит к уменьшению объема сократительной мышцы, но и дополнительно обременяет оставшуюся мышцу. При хроническом воспалении персис-тирующее повреждение приводит к разрушению ткани и рубцеванию.
Воспаление и восстановление являются динамичными процессами, регулирующимися клеточными и внеклеточными медиаторами и обеспечивающими самоподдержание человеческого организма.
Глава 5.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
