6.1. контроль роста клеток
6.1. контроль роста клеток
Пролиферацию клеток могут вызвать повреждение, гибель клеток или механическая деформация тканей. Известно, что пролиферация в значительной мере контролируется биохимическими факторами микроокружения. Последнее стимулирует или тормозит деление клеток. Избыток стимулирующих или недостаточность тормозящих воздействий приводят к экстенсивному росту, который, например у злокачественных опухолей, приобретает нерегулируемый или плохо регулируемый характер. Рост может осуществляться за счет укорочения клеточного цикла, но более важным является процесс пополнения массы клеток, участвующих в цикле, за счет тех, которые находятся в фазе G0.
Клеточный цикл и типы клеток. Понятия о клоне, д и ф-фероне и ткани. На основании способности к пролиферации и отношения к клеточному циклу (схема 6.1) все клетки разных тканей человека можно разделить на три группы: непрерывно делящиеся, или лабильные; покоящиеся, или стабильные; неде-лящиеся, или неизменные (перманентные), клетки.
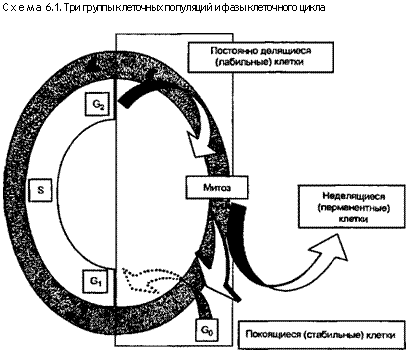 1. Непрерывно делящиеся (лабильные) клетки совершают свой цикл путем перехода от одного митоза к другому, затем к следующему и т.д. Их назначение состоит в возмещении тех клеток, которые подвергаются непрерывному разрушению или слущи-ванию. Такие лабильные клетки всегда есть в эпидермисе, эпителии полости рта и слюнных желез, пищеварительного и мочевого трактов, желчевыводящих путей и половых органов, а также в тканях костного мозга и органов гемопоэза. В большинстве этих тканей физиологическое обновление (регенерация) осуществляется из популяций, берущих начало от стволовых клеток. Последние генетически фиксированы в недифференцированном состоянии и имеют неограниченную способность к делению. Одна часть их потомков остается во фракции лабильных клеток, другая — проходит этапы дифференцировки. Для того чтобы не было избыточного или недостаточного воспроизведения таких потомков, стволовые клетки, а также их производные — лабильные клетки — с помощью рецепторов воспринимают из своего микроокружения сигналы, регулирующие количество непрерывно делящихся клеток. Большую или меньшую часть лабильных клеток эти сигналы могут направить по пути дифференцировки, когда клетки теряют способность к делению. Такое согласованное взаимодействие в микроокружении называется межклеточной интеграцией.
1. Непрерывно делящиеся (лабильные) клетки совершают свой цикл путем перехода от одного митоза к другому, затем к следующему и т.д. Их назначение состоит в возмещении тех клеток, которые подвергаются непрерывному разрушению или слущи-ванию. Такие лабильные клетки всегда есть в эпидермисе, эпителии полости рта и слюнных желез, пищеварительного и мочевого трактов, желчевыводящих путей и половых органов, а также в тканях костного мозга и органов гемопоэза. В большинстве этих тканей физиологическое обновление (регенерация) осуществляется из популяций, берущих начало от стволовых клеток. Последние генетически фиксированы в недифференцированном состоянии и имеют неограниченную способность к делению. Одна часть их потомков остается во фракции лабильных клеток, другая — проходит этапы дифференцировки. Для того чтобы не было избыточного или недостаточного воспроизведения таких потомков, стволовые клетки, а также их производные — лабильные клетки — с помощью рецепторов воспринимают из своего микроокружения сигналы, регулирующие количество непрерывно делящихся клеток. Большую или меньшую часть лабильных клеток эти сигналы могут направить по пути дифференцировки, когда клетки теряют способность к делению. Такое согласованное взаимодействие в микроокружении называется межклеточной интеграцией.
Популяция, или линия, однопрофильных (дифференцированных в одном направлении) клеток, потомков одной стволовой клетки, образует клон. Совокупность или система интегрированных однопрофильных клонов составляет дифферон. Последний является уже более крупной составной частью ткани. Ткань — это частная морфофункциональная система организма, состоящая из одного или нескольких (разнопрофильных) согласованно взаимодействующих дифферонов и обладающая какими-либо специфическими функциями. Органоспецифическую ткань, определяющую фенотип, т.е. совокупность признаков органа, называют паренхимой, а опорную ткань, в которой проходят сосуды, нервы и разные магистрали, — стромой.
В составе эпидермиса имеется три дифферона — доминирующий, профильный, т.е. кератиноцитарный; меланоцитар-ный, специализированный дифферон макрофагальных клеток Лангерганса, тоже имеющий специализированные признаки.
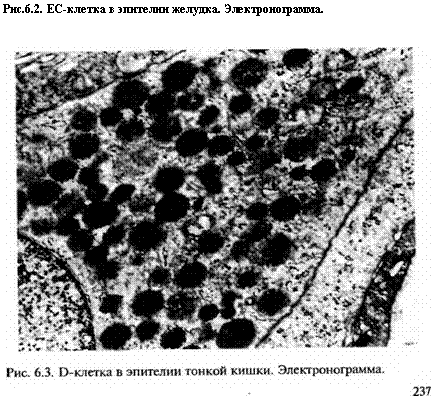
В состав эпителия пищеварительного, дыхательного, моче-выводящего трактов входят диффероны рассеянных нейроэндо-кринных клеток. Все вместе они образуют диффузную эндокринную систему. Нейроэндокринные клетки выявляются с помощью импрегнации (пропитывания) гистологических срезов солями серебра, поэтому получили название аргирофильных, или аргентаффинных, клеток (аргирофильность — способность окрашиваться в черный или коричневый цвет в присутствии восстановителей серебра; аргентаффинность — способность восстанавливать серебро из его солей без участия восстановителей, окрашиваясь в те же цвета). Их также можно выявить с помощью иммуногистохимических реакций (см. главу 1) на какие-либо продукты этих клеток (рис. 6.1), вырабатываемые электронно-плотными цитоплазматическими гранулами (рис. 6.2; 6.3). Нейроэндокринные клетки секретируют (выделяют в кровь и лимфу), реже экскретируют (в выводной проток или в полость) нейроамины и белковые (олигопептидные) гормоны путем поглощения и декарбоксилирования предшественников амина (Amine Precursor Uptake and Decarboxilation — APUD). Отсюда появились другие названия для нейроэндокринных дифферонов и соответствующих клеток: APUD-система, апудоцитарные диффероны, апудоциты. Нейроэндокринные диффероны в указанных эпителиях, конечно значительно уступают в количественном отношении профильным эпителиоцитам. Иногда они развиты настолько слабо, что их клетки приходится выискивать. Однако из этих клеток все же могут развиваться специфические опухоли, в которых апудоциты доминируют (см. главу 7).
2. Покоящимся (стабильным) клеткам свойствен низкий уровень митотической активности. Однако в ответ на действие различных митогенных стимулов эти клетки способны к весьма
Рис 6.1. Серотонинсекретирующая нейроэндокринная клетка в выстил -ке простатической части уретры. ПАП-метод.
быстрому размножению и восстановлению первоначальной ткани. Считается, что они пребывают в фазе G0, но могут быть переведены (при стимуляции) в фазу G,. К покоящимся, или стабильным, относятся паренхиматозные клетки многих органов: печени, почек, поджелудочной железы, а также мезенхи-мальные клетки — фибробласты, гладкомышечные клетки и эндотелий сосудов. Способность стабильных клеток к регенерации лучше всего иллюстрируется на примере регенерации печени после гепатэктомии либо какого-нибудь вирусного, токсического или химического повреждения.
Несмотря на то что и лабильные, и стабильные клетки способны к регенерации, полного восстановления существовавшей нормальной структуры может не произойти. Для правильно организованной регенерации какой-либо паренхимы нужна подлежащая и поддерживающая строма, формирующая необходимый каркас и участвующая в кровоснабжении растущей ткани. В частности, при регенерации эпителия очень важна базальная мембрана, без которой делящиеся эпителиоциты не восстанав-
ливают первоначального порядка своего расположения (полярной ориентации, послойного распределения и др.). При легких вирусных поражениях печени сохранившийся стромальный остов дает возможность для полного восстановления долек органа, а абсцесс печени, расплавляющий паренхиму и строму, заканчивается рубцеванием
Клетки соединительнотканного и мезенхимального происхождения — фибробласты, эндотелий, гладкомышечные клетки, хондроциты и остеоциты — являются покоящимися. Однако в ответ на повреждение все они способны к пролиферации. В первую очередь это касается фибробластов, размножающихся подчас настолько интенсивно, что это приводит к формированию рубцовых полей.
3. Неделящиеся, или неизменные (перманентные), клетки вышли из клеточного цикла и в родившемся и далее живущем организме уже не могут подвергаться митотическому делению. К этой группе клеток относят нервные клетки (нейроны), поперечнополосатые мышечные волокна и кардиомиоциты. Если нейроны головного мозга разрушаются, то они утрачиваются навсегда. Замещение их происходит за счет опорных элементов мозговой ткани, глиальных клеток. Скелетная мускулатура обладает некоторой способностью к регенерации, которая обычно осуществляется путем трансформации сателлитных клеток, находящихся в прослойках эндомизия (внутримышечной рыхлой стромы). Если в эксперименте на млекопитающих добиться хорошего сопоставления и фиксации разорванных мышечных волокон, то можно достичь отличного сращения, однако в медицинской практике такое бывает исключительно редко. Что касается клеток миокарда, то их возможности к регенерации ограничены. Поэтому подавляющее большинство повреждений, имеющих сколько-нибудь значительный объем, заканчивается рубцеванием. В частности, это относится к перенесенным инфарктам миокарда.
Молекулярные механизмы роста клеток (по R.S.Cotran, V.Kumar, T.Collins, 1998). Несмотря на то что многие биохимические субстанции могут воздействовать на рост клеток, наиболее важными из них все же являются полипептидные факторы роста, имеющиеся в сыворотке крови или вырабатываемые клетками. Некоторые из указанных веществ являются факторами компетенции, которые сами не стимулируют синтез ДНК, но, переводя клетки в фазы G0 или G,, делают их способными (компетентными) к такому синтезу. Другие субстанции представляют собой факторы прогрессии, стимулирующие синтез ДНК в компетентных клетках. Большинство факторов роста влияет также на многочисленные функции клеток, например на их миграцию, дифференцировку, процессы восстановления ткани. Они могут участвовать в различных стадиях заживления ран.
Пониманию молекулярных механизмов клеточной пролиферации способствовало открытие того факта, что онкогены (гены, вовлеченные в процесс формирования злокачественных опухолей) обладают полной гомологичностью (генетическим соответствием) тем клеточным генам (протоонкогенам), которые участвуют в контроле нормального роста клеток. Учение об онкогенах и протоонкогенах будет рассмотрено в главе 7. Здесь же мы остановимся на описании последовательных молекулярных процессов, приводящих к делению клеток, и тех белков, которые принимают участие в контроле за ростом клеток и подчас вовлекаются также в опухолевый рост.
Связывание лигандов с рецепторами (о лигандах и рецепторах см. главу 2). Пролиферация клеток начинается со связывания предполагаемого фактора роста (лиганда) со специфическими рецепторами, находящимися на поверхности плазмолеммы или внутри клетки. Лиганды и рецепторы представляют собой сложные белковые молекулы, но если функция первых имеет в основном стимулирующий характер, то функция вторых — избирательно-связующая. Большинство факторов роста имеет рецепторы на плазмолемме, однако стероидные рецепторы располагаются внутри клеток и взаимодействуют с липофильными лигандами. Последние проникают через плазмолемму для того, чтобы взаимодействовать с рецепторами в ядре или цитоплазме.
Активация рецепторов факторов роста. Большинство таких рецепторов, например рецепторы эпидермального фактора роста и тромбоцитарного фактора роста, входит в семейство трансмембранных белков, цитоплазматический домен которых обладает тирозинкиназной активностью. Такие рецепторные киназы имеют большие гликозилированные домены для внеклеточного связывания лигандов, короткие гидрофобные трансмембранные участки, а также цитоплазматические домены, в которых выявлена активность тирозинкиназы. Связывание с лигандом вызывает структурную перестройку внеклеточного домена, который в свою очередь вызывает димеризацию рецепторов (димеризация — это возникновение ковалентных — межатомных — связей у соседних оснований нити ДНК). Предполагается, что димеризация при наличии взаимодействия между прилежащими цитоплазматическими доменами приводит к активации (фосфорилирующему действию) киназы.
Трансмембранные рецепторы факторов роста, не связанные с активностью киназы, перемещают внутри клетки внутриклеточные протеинкиназы к периферической зоне клетки. В результате всего этого активируется каскад процессов фосфорили-рования белка, который заставляет покоящиеся клетки вступать в пролиферативный цикл.
3. Сигнальная трансдукции и вторичные мессенджеры (см.
главу 2). Тирозинкиназы необходимы для сигнальной трансдукции (переноса генетического материала, в данном случае сиг-
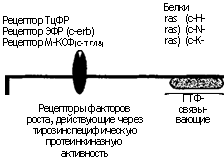 Схема 6.2. Активность и локализация основных классов протоонкогенов
Схема 6.2. Активность и локализация основных классов протоонкогенов
ТцФР (c-sis) ЭФР М-КСФ
Факторы роста

(c-fes)
Цитоплазматические тирозинспецифические протеинкиназы
Рецептор гормона щитовидной железы (С-егЬА)
(c-mos) (с-гаП
Рецепторы факторов
роста стероидного
типа
Серин/треонин/ специфические протеинкиназы
Обозначения: ТцФР тромбоцитарный фактор роста, ЭФР эпидермапьный фактор роста, М-КСФ моноцитарный колониестимулирующий фактор роста, ГТФ гуанидинтрифосфат
нальных белков) и поэтому фосфорилирование остатков тирозина на одной или более белковых молекулах-мишенях является решающим событием в переходе всего процесса от внеклеточных сигналов к финалу, т.е. к пролиферации клеток. Некоторые белки, размещенные на внутренней поверхности плазмолеммы или близко к ней, принимают участие в передаче указанных сигналов. Первоначальная активация сигнальных белков является следствием связывания специфических доменов с фосфо-тирозином активированного рецептора. К сигнальным белкам относят три вида субстанций — фосфолипазу С-у, ГТФ-связан-ные белки и Raf-І (см. главу 2).
Фосфолипаза С-у катализирует расщепление Р1Р2, приводя к формированию двух вторичных мессенджеров: 1Р3, освобождающего внутриклеточные запасы кальция, и ДАГ. Последний в свою очередь активирует протеин киназу С, входящую в семейство серинтреонинкиназ, связанных с плазмолеммой и, таким образом, находящихся в той же перимембранной зоне, что и кц-назы рецепторов (см. главу 2).
ГТФ-связывающие белки — хорошо известные G-белки, относящиеся к семейству белков ras (схема 6.2). Они функционируют путем соединения внеклеточных сигналов с клеточными эффекторами, например с фосфолипазой. В норме белки ras находятся в неактивной ГДФ-связанной форме. С помощью белкового комплекса, создающего мост между рецептор-ным фосфотирозином и ras, эта форма превращается в активный ГТФ-связанный белок. Активация ras нейтрализуется белком, активирующим ГТФазу. Она повышает ГТФ-азную активность белка ras, переводя его в неактивную ГДФ-форму. В свою очередь активированный ras фосфорилирует группу цито-плазматических ферментов, которые называют протеинкиназа-ми, активированными митогенами. Таким образом, ras играет центральную роль в сигнальной трансдукции, приводящей к митозу. Поэтому не удивительно, что около трети всех злокачественных опухолей человека содержат мутантные версии белков ras.
Raf-1 — серинтреонинкиназа, которая активируется факторами роста. Этот фермент активируется белком ras, затем он сам активирует оставшуюся часть протеинкиназ, активированных митогенами.
Фосфорилирование белков нейтрализуется несколькими клеточными фосфатазами. Последние усиленно изучают как регуляторы клеточного роста или факторы, уравновешивающие действие киназ и выступающие в роли ингибиторов роста, или непосредственно влияющие на белковые субстраты, важные для развития митоза.
4. Факторы транскрипции. Точный механизм, с помощью которого сигналы для митоза проводятся через цитоплазму, остается неясным. Однако каскад протеинкиназ и различные вторичные мессенджеры (Са2+, кальмодулин) в конце концов передают сигнал роста в ядро клетки, в котором стимулируется большое количество генов. Последние подразделяют на гены-регуляторы роста на ранних и на поздних стадиях. Ранние регуляторы (c-fos, c-jun, c-myc) обеспечивают повышение уровня матричных РНК еще до достижения середины фазы цикла G, и активируются при отсутствии синтеза белка. У поздних регуляторов роста уровень мРНК начинает повышаться в середине фазы G, или даже на границе фаз G, —Gs. Они зависят от синтеза белка. Следует отметить, что немедленный ранний ответ генов активирует не только факторы роста, но и некоторые вредоносные стимулы при повреждениях ишемической, химической, лучевой и другой природы. Среди генов-регуляторов роста имеются протоонкогены, в которых могут происходить мутации, связанные со злокачественной трансформацией (см. главу 7). Некоторые из них, например myc, fos и jun, кодируют факторы транскрипции и участвуют в регуляции синтеза ДНК и, возможно, в делении клеток. Важность функции этих протоонкоге-нов в воспроизведении клеток хорошо иллюстрируется на примере их экспрессии при репаративной регенерации печени после гепатэктомии.
5. Клеточный цикл и циклины. До сих пор речь шла о процессах, вызванных стимуляцией факторов роста. Возникает вопрос, что же служит непосредственным сигналом к согласованным событиям, приводящим к делению клетки. Эти события контролируются с помощью изменений внутриклеточной концентрации и активности группы белков, названных циклинами. Эти белки формируют комплекс с протеинкиназой, названный cdc2 или p34cdc2.
Циклинкиназные комплексы фосфорилируют несколько субстратных белков, участвующих в репликации ДНК, формировании митотического веретена и в других процессах клеточного цикла. Перед вступлением клетки в S-фазу резко возрастают уровни циклинов G] (в частности, циклинов D,, Е), а репликацию ДНК запускают комплексы циклинов G,-cdc2. В ходе фазы G2 активируются гены для набора различных циклинов, тоже имеющих свое обозначение как циклины G2 или В. Фосфорили-рованный комплекс сс1с2-циклин В представляет собой активную киназу, вызывающую митоз, дальнейшей активации которого способствуют несколько киназ и фосфатаз. После деления клетки циклины В расщепляются. В присутствии стимуляторов дочерние клетки снова начинают свой цикл. Некоторые онкогены, например bcl-l, антионкогены, например ген Rb, и, возможно, р53, контролируя рост клеток, тоже действуют в системе циклинов (см. главу 7).
Таким образом, полипептидные факторы роста связываются со своими рецепторами и активируют их. Многие из этих рецепторов обладают тирозинкиназной активностью. При активации фосфорилируются несколько субстратов, участвующих в сигнальной трансдукции и формировании вторичных мессенд-жеров, включая белки ras, фосфолипазу С-у и raf-І. В свою очередь каскад киназ передает сигналы к ядру клетки, где активация факторов транскрипции приводит к началу синтеза ДНК и в конце концов к делению клетки.
Торможение роста клеток — обратная сторона пролифера-тивного процесса. Наличие сигналов, тормозящих рост и поддерживающих целостность ткани, было заподозрено несколько десятков лет назад на основании того, что разные популяции клеток в культуре или in vivo могут ограничивать рост друг друга. Одним из проявлений такого торможения роста является его контактное торможение при слиянии клеточных культур. Другой пример in vivo: после частичной гепатэктомии печеночные клетки прекращают пролиферацию, когда орган достигает своих нормальных (бывших до операции) размеров и конфигурации. Это наводит на мысль о действии каких-то ингибитор-ных сигналов. Открытие факта, что в определенных злокачественных опухолях наблюдается утрата опухолесупрессорных генов (антионкогенов), свидетельствует о возможности кодирования такими генами компонентов, участвующих в торможении роста. Это торможение, как и стимуляция роста, осуществляется с использованием полипептидных факторов и сигнальных трансдукторов, включая рецепторы клеточной поверхности, вторичные цитоплазматические мессенджеры и регуляторы транскрипции.
Несмотря на то что изучение опухолесупрессорных генов прояснило ряд вопросов, связанных с ростом опухоли (см. главу 7), лишь некоторые механизмы его стимуляции и ингибиции получили предварительное объяснение. К числу полипептидных факторов, действующих в качестве ингибиторов роста, относятся ТФРр, ФНОа и ИФНр. Кроме того, подавлению восприимчивости клетки к растворимым митогенам в местном микроокружении могут также способствовать и молекулы нерастворимого внеклеточного матрикса.
Наконец, следует упомянуть, что оба механизма — торможение и стимуляция роста — часто взаимозависят друг от друга. Примером этого служит взаимодействие продукта опухолесу-прессорного гена с нормальным белком р21 гена ras,.направленное на инактивацию белка р21 в опухолевой ткани при нейро-фиброматозе I типа (см. главу 7). Дело в том, что белок гена ras участвует в сигнальной трансдукции после стимуляции факторами роста.
Факторы роста. В настоящее время их относят к системе цитокинов (см. главу 2). Некоторые из полипептидных факторов роста воздействуют на многие типы клеток, в то время как другие избирают довольно специфичные мишени. Помимо пролиферации, факторы роста влияют на передвижение, сократимость и дифференцировку клеток. Этот эффект может иметь столь же важное значение для восстановительных процессов и заживления ран, как и воздействия, способствующие росту.
Факторы роста действуют с помощью сигналов эндот, пара-или аутокринного характера (см. главу 2)< .Паракринная стимуляция чаще встречается при восстановлении соединительной ткани в заживающих ранах, в которых фактор, произведенный одним типом клеток, стимулирует рост прилегающих клеток других типов. Именно так действуют на фибробласты факторы роста, вырабатываемые макрофагами. Однако многие клетки снабжены рецепторами для эндогенно вырабатываемых факторов роста (аутокринная стимуляция). Такой эндогенный механизм играет роль при компенсаторной эпителиальной гиперплазии, а также при опухолевом росте (см. схему 6.2).
1. Эпидермалъный фактор роста (ЭФР) и ФНОа. ЭФР был впервые обнаружен благодаря его способности вызывать преждевременное прорезывание зубов и раскрытие век у новорожденных лабораторных мышей. Он является митогеном для эпителиальных клеток всевозможных типов, а также для фибробластов, вызывая в то же время деление гепатоцитов in vivo. Это фактор прогрессии, стимулирующий клетки к митозу путем связывания со специфическими тирозинкиназными рецепторами на плазмолемме. Рецептором ЭФР является с-erbBl. ЭФР всегда может быть обнаружен в различных секретах и тканевых жидкостях (слюна, моча, содержимое кишки).
ФНОа первоначально выделили из клеток саркомы, индуцированной вирусом в эксперименте. Он вызывал некроз опухолевых клеток. В связи с этим возникла мысль об участии этого фактора в процессе предотвращения малигнизации нормальных клеток. Позднее обнаружили, что он на значительном протяжении (своей молекулы) гомологичен (имеет структурное сходство или соответствие) с ЭФР, связывается с рецептором последнего и осуществляет большинство из активирующих функций ЭФР.
Тромбоцитарный фактор роста (ТцФР) — высококатион-ный белок с массой около 30 ООО Да, состоящий из двух цепей — А и В. ТцФР сохраняется в а-гранулах тромбоцитов и освобождается при активации этих клеток. Он вырабатывается также активированными макрофагами, эндотелиальными и гладкомышечными клетками, моноцитами, например при воспалении. Этот фактор связывается со специфическими рецепторами двух типов — аир, имеющими протеин киназную активность, но в отличие от ЭФР он запускает клеточный цикл, действуя как фактор компетенции. Поэтому для митогенеза ему нужны факторы прогрессии (ЭФР, вещества плазмы, инсулин).
Семейство факторов роста фибробластов (ФРФ) впервые было описано как митогены фибробластов после того, как их удалось выделить из головного мозга и гипофиза быков. Основные формы — осн(5вный и кислый ФРФ (оФРФ, кФРФ) — представляют собой семейство полипептидных факторов со многими видами активности дополнительно к той, которая стимулирует рост. В частности, оФРФ способен запускать все этапы формирования новых сосудов (ангиогенез) in vivo и in vitro. Обнаружено тесное родство ФРФ с гепарином (гепарин-связующими факторами роста) и с другими анионными молекулами. Эти факторы хорошо связываются со структурами внеклеточного матрикса. оФРФ определяется в экстрактах, взятых из многих органов, и вырабатывается активированными макрофагами. Наличие кФРФ ограничено нервной тканью. Семейство ФРФ стремительно расширяется. В настоящее время активно изучаются фактор роста кератиноцитов и фактор роста гепато-цитов.
Трансформирующий фактор роста (ТФР)Р и связанные с ним факторы роста. ТФРр относится к семейству гомологичных (сходных) полипептидов, которое включает три изоформы указанного фактора (ТФРр-1—3), а также такие факторы, обладающие широкими функциями, как морфогенетический белок кости и мюллеровский ингибиторный фактор. ТФРр-1 распространен у млекопитающих и оказывает разные и часто противоположные эффекты. In vitro, т.е. в культуре ткани, он является ингибитором роста для большинства типов эпителиоцитов. Но воздействие на пролиферацию фибробластов и гладкомышеч-ных клеток у него различное. В маленьких концентрациях этот фактор вызывает синтез и секрецию ТцФР и, таким образом, имеет непрямое митогенное действие. При высоких концентрациях он тормозит рост благодаря своей способности ингибиро-вать экспрессию рецепторов ТцФР. ТФРр служит хемоаттрак-тантом для фибробластов и стимулирует продукцию коллагена и фибронектина этими клетками. Одновременно он тормозит расщепление коллагена путем снижения уровня протеаз и повышения уровня тканевых ингибиторов протеиназ. Все указанные функции способствуют фиброгенезу или фибропластике, поэтому понятно, что ТФРр вовлечен во всевозможные варианты фиброза или склероза при хронических воспалительных процессах. Этот фактор вырабатывается различными типами клеток. Основным его источником в организме являются тромбоциты, эндотелий, Т-лимфоциты и макрофаги.
5. Другие цитокины (см. главу 2). Наличие взаимоперекры-вающих функций у двух групп медиаторов (факторов роста и других цйтокинов) делает различия между ними несущественными. Например, ИЛ-1 и ФНОа являются для фибробластов митогенными и стимулирующими их хемотаксис факторами. Кроме того, они оба вызывают синтез коллагена и коллагена-зы фибробластами, а потому известны как фиброгенные цитокины.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
