Методы исследования в патологической анатомии
Методы исследования в патологической анатомии
Объекты, изучаемые патологоанатомом, можно разделить на три группы: трупный материал, субстраты, полученные от больных при их жизни (органы, ткани и их части, клетки и их части, продукты секреции, жидкости) и экспериментальный материал.
1. Трупный материал. Традиционно органы и ткани трупов умерших являются предметом изучения в ходе патологоанато-мических вскрытий (аутопсий, секций) лиц, умерших от болезней. Случаи смерти, произошедшей не от болезней, а в результате преступлений, катастроф, несчастных случаев или неясных причин, исследуют судебные медики.
Трупный материал исследуют на анатомическом (табл. 1.1) и гистологическом уровнях. Реже используются рентгенологические, микробиологические и биохимические методы. В патолого-анатомическое отделение вместе с покойником доставляются история болезни и вся имеющаяся Медицинская документация. Перед вскрытием патологоанатом обязан все это изучить, а затем пригласить на аутопсию лечащих врачей. Клиницисты должны удостовериться в тех находках, которые подтверждают или опровергают их представления о процессах и изменениях, произошедших в организме при жизни больного. Нередко во время вскрытия между клиницистами и патологоанатомом возникают профессиональные споры. Результаты аутопсии патологоанатом заносит в протокол вскрытия, а причины смерти больного указывает в свидетельстве о смерти, которое затем выдает родственникам покойного.
Основная цель аутопсии — установление окончательного диагноза и причин смерти больного. Оцениваются также правильность или ошибочность клинического диагноза, эффективность лечения. Существуют критерии оценки расхождений клинического и патологоанатомического диагнозов, а также классификация причин расхождений (см. главу 10). Другая цель вскрытия — взаимное обогащение научно-практического опыта клиницистов и патологоанатомов. Значение секционной работы
патологоанатома состоит не только в контроле за качеством лечебно-диагностической деятельности клиницистов (контроль этот сложен и осуществляется не только патологоанатомами), но и в накоплении статистических и научно-практических данных о болезнях и патологических процессах.
Если секционная работа организована высокопрофессионально и адекватно оснащена методически, то выполнение ее в полном объеме в настоящее время обходится очень дорого. Например, в США стоимость одной аутопсии с дополнительными исследованиями превышает 1 тыс. долларов. Поэтому родственники умершего, страховые компании и другие лица и организации, вносящие деньги в госпитальную кассу, довольно редко соглашаются оплатить аутопсию, особенно если клинический диагноз не вызывает сомнений. Это и стало одной из причин значительного сокращения числа госпитальных вскрытий в ряде промышленно развитых стран. Тенденция к сокращению количества вскрытий наметилась и в России.
2. Материал, взятый при жизни больного. Гораздо больший объем в работе патологоанатома занимает микроскопическое изучение материала, полученного с диагностической целью при жизни больного. Чаще всего такой материал поступает от оперирующих клиницистов: хирургов, гинекологов, урологов, оториноларингологов, офтальмологов и др. Понятно, что диагностическая роль патологоанатома здесь велика и его заключение нередко определяет формулировку клинического диагноза. Для патологоанатома существует правило: «Нельзя садиться к микроскопу, не обладая полной и адекватной клинической информацией» о поступившем материале». Последняя должна сопровождаться не только паспортными данными больного, но и развернутым клиническим диагнозом, а также сведениями о локализации, продолжительности и особенностях течения процесса.
При необходимости должны быть приведены и данные лабораторных анализов. Чаще всего объекты, взятые оперирующими клиницистами, исследуют гистологически или цитологически.
Гистологическое исследование. Этому исследованию подвергаются операционный и биопсийный материалы. При поступлении к патологоанатому операционного материала клинический диагноз, как правило, уже установлен. Требуется лишь гистологическое подтверждение (уточнение) диагноза. Однако в случае биопсии и сама операция, и взятие материала (биоптат) производятся с целью установления диагноза, в данном случае гистологического. В обеих ситуациях чрезвычайно важна немедленная фиксация удаленных тканей в формалине (10—15 \% водный раствор формальдегида), в крайнем случае — в 70—96 \% этиловом спирте или в ацетоне. Даже не очень долгое пребывание удаленных кусочков или субстратов на воздухе, в воде или солевом растворе может привести к необратимым, искусственно вызванным изменениям в материале, которые затруднят или исключат постановку правильного гистологического диагноза. Большие фрагменты и части органов следует перед помещением в фиксатор разрезать на пластины толщиной 0,5 см, проложив их затем лоскутами ваты или марли. Разрезы желательно делать без пересечения анатомических магистралей (каналы следует вскрывать), без нарушения анатомо-топографических связей, особенно между патологическим очагом и окружающими тканями. Объем фиксатора должен превышать объем объекта не менее чем в 10, лучше в 15—20 раз. При комнатной температуре время фиксации составляет 1—2 сут, в 37-градусном термостате оно сокращается до 15—17 ч.
Из фиксированного материала острой бритвой вырезают кусочки не более 1 см диаметром, затем их закладывают в специальные кассеты и помещают в автоматы для гистологической проводки. В них они проходят через ряд спиртов восходящей крепости, масел, затем через хлороформ и жидкий парафин. Вся эта процедура занимает несколько часов. Затем обезвоженный и обезжиренный материал, пропитанный парафином, заливают в специальных формах другим жидким парафином, охлаждают и иссекают в виде отдельных парафиновых блоков. Последние закрепляют в микротоме, после чего нарезают с них гистологические срезы толщиной 5—10 мкм. Срезы наклеивают на предметные стекла, де парафинируют, окрашивают тем или иным способом, затем заключают в оптически прозрачные среды под покровное стекло.
При срочных биопсиях, проводимых нередко во время обширных вмешательств, с целью быстрого получения гистологического диагноза, часто определяющего ход и объем операции, фиксируют небольшие кусочки (биоптаты) в кипящем формалине. Ткань, фиксированную таким способом, охлаждают, затем замораживают и нарезают на криостате или замораживающем микротоме. Замороженные срезы обычно толще парафиновых, но они пригодны для предварительной диагностики. В этом случае на приготовление гистологического препарата затрачивается 15—30 мин, после чего патологоанатом, исследовав препарат, сообщает клиницисту свой диагноз. Криостат и замораживающий микротом применяют также и в других ситуациях: с целью избежать гистологической проводки и сохранить спир-торастворимые и прочие компоненты в ткани, которые бывают важны для диагностики (например, жир).
Для обычной диагностики широко используют универсальную гистологическую окраску срезов гематоксилином и эозином. Тинкториальные, т.е. красящие, свойства гематоксилина реализуются в слабощелочной среде, и структуры, окрашенные этим красителем в синий или темно-синий цвет, принято называть базофильными. К ним относятся ядра клеток, отложения солей извести и колонии бактерий. Слабую базофилию могут давать некоторые виды слизи. Эозин, напротив, при рН менее 7 окрашивает так называемые оксифильные компоненты в розово-красный или красный цвет. К ним относятся цитоплазма клеток, волокна, эритроциты, белковые массы и большинство видов слизи. Очень часто применяют окраску пикрофуксином по Ван-Гизону (l.Th. van Gieson), элективно, т.е. избирательно, окрашивающую в красный цвет коллагеновые волокна соединительной ткани, тогда как прочие структуры становятся желтыми или зеленовато-желтыми. Метод Ван-Гизона позволяет обнаружить даже небольшое количество соединительной ткани, неразличимое при окраске гематоксилином и эозином. Существует множество гистологических окрасок для выявления тех или иных компонентов ткани или патологических субстратов. Важнейшие из них мы будем называть при описании соответствующих изменений.
Цитологическое исследование проводят по мазкам, сделанным из содержимого полых или трубчатых органов, а также по препаратам-отпечаткам, пунктатам и аспиратам (аспирацион-ным пунктатам, отсасываемым шприцем). Мазки нередко изготавливают из материала смывов со стенок органов, что позволяет захватить клетки, находящиеся в процессе естественного или патологического слущивания (десквамация, эксфолиация), например с шейки матки. Более активным вмешательством является соскоб со стенок органов. Если материал соскоба обилен, то его обрабатывают с помощью гистологических методик. В частности, так поступают с диагностическими соскобами эндометрия. При скудных соскобах материал идет в цитологическую обработку. Нередко препараты изготавливают из мокроты, слизи, тканевых вытяжек и осадков в жидкостях. Осадки можно получить после центрифугирования взвесей.
В онкологической практике распространено получение пунктатов с помощью специальной длинной и тонкой иглы без мандрена, снабженной выраженным косым срезом. В частности, широко исследуют аспирационные пунктаты, для которых нужны ультратонкие иглы. Аспирационную пункцию (FNA, Fine-needle aspiration) глубокорасположенных тканей и органов проводят под контролем ультразвукового исследования или компьютерной магнитно-резонансной томографии.
Цитологический материал фиксируют обычно прямо на предметном стекле, часто во время окраски. Наиболее популярны окраски азур-эозином (его тинкториальные свойства близки к гематоксилину и эозину) или бисмарк-брауном по Папанико-лау (C.N.Papanicolaou, 1883—1962, американский цитолог, основатель клинической цитологии, по аббревиатуре имени которого укоренилось обозначение цитологических мазков как Pap-smears). Сейчас созданы системы массового анализа (скрининг) PapNET, выводящие одномоментно по 20 полей зрения и более с цитологических мазков на экран компьютера и позволяющие изучить до 1000 полей зрения в одном препарате. Применение PapNET повышает результативность онкоцитологической диагностики на 30 \% по сравнению с обычной микроскопией мазков.
Иммуногистохимическое исследование. При некоторых патологических состояниях, особенно опухолях, бывает трудно и даже невозможно с помощью гистоили цитологических окрасок определить тип ткани или ее происхождение (гистогенез). Подобные трудности возникают и при установлении вида возбудителя инфекции. Между тем верификация здесь имеет важное значение для диагностики и прогнозирования. Поэтому используют различные дополнительные методические подходы. Одним из них является иммуногистохимический метод. При нем на гистоили цитологические препараты наносят растворы с антителами к искомым антигенам — опухолевым, вирусным, микробным, аутоантигенам и др. Антигены при обычных гистологических окрасках тканей не видны. Антитела в сыворотках несут на себе метку: либо флуорохром, т.е. краситель, светящийся в темном поле (иначе говоря, дающий флуоресценцию), либо красящий фермент. Если искомый антиген есть в исследуемых тканях или клетках, то возникший комплекс антиген-антитело плюс маркер точно укажут его локализацию, количество, помогут изучить некоторые свойства.
Иммунофлуоресценцию чаще всего используют при изучении срезов, приготовленных в криостате или на замораживающем микротоме, а также при исследовании цитологических препаратов. Применяют сыворотки с антителами (так называемые антисыворотки), конъюгированные чаще всего с таким надежным флуорохромом, как флуоросцеин-изотиоцианат. Наиболее популярен непрямой метод, позволяющий выявить антигены с помощью двойной реакции с антителами. Для этого препарат обрабатывают сывороткой крови больного, содержащей
 |
антитела, затем после ее удаления и промывки — антисывороткой с антителами, меченными флуорохромом. Так поступают при поиске тканевых антигенов (белков, гормонов), микроорганизмов, а также иммунных комплексов.
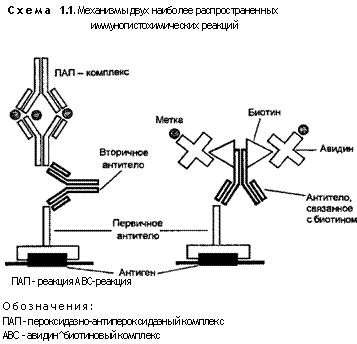
Еще более распространен иммунопероксидазный метод. Антитела красящей сыворотки несут не флуорохром, а фермент — пероксидазу хрена, реже другой энзим, например щелочную фосфатазу. Существует несколько вариантов указанного метода. Наиболее часто используют два из них — пероксидазно-антипероксидаэный (PAP-method, ПАП-метод) и метод авидин-био-тинового комплекса (ABC-method, ABC-метод) (схема 1.1). При ПАП-методе цепь промежуточных антител, связывающих энзим с антигеном, несколько длиннее, чем при непрямом иммуно-флуоресцентном методе. Энзимное, т.е. пероксидазное, антитело связывается с первичным антителом, уже находящимся на антигене, посредством еще одного антитела-мостика. Последний как бы развернут к связываемым звеньям так, чтобы своими короткими иммуноглобулиновыми цепями связать их длинные цепи. Таким образом, имеется 3 слоя субстанций: антиген со связанным антителом в ткани, антитело-мост и ПАП-комплекс, в котором молекулы пероксидазы располагаются между двумя короткими цепями двух связанных антител, несущих энзим.
При авидин-биотиновом методе первичное антитело, находящееся на антигене и меченное биотином, связывается с ПАП-комплексом через промежуточное антитело, меченное авиди-ном (см. схему 1.1). Оба белка — авидин и биотин — резко повышают качество реакции, и потому ABC-метод считается более чувствительным.
Для иммуногистохимических реакций используют 2 типа антител: полии моноклональные. Первые получают из антисывороток иммунизированных кроликов, у которых, правда, могут формироваться различные дополнительные иммуноглобулины, дающие помехи в реакциях, что является недостатком метода. Однако его достоинствами являются дешевизна и чувствительность к широкому спектру антигенов. Моноклональные антитела получают в культуре тканей или из асцитической жидкости, полученной из брюшной полости лабораторных животных. Последним перед этим вводят внутрибрюшинно взвесь клеток миеломы (опухоль из плазматических клеток — продуцентов антител), которые отобраны для выработки антител. Эти селективные клеточные линии (клоны) предварительно получают путем искусственного слияния клеток миеломы с лимфоцитами селезенки лабораторных мышей, иммунизированных искомым антигеном. Такое слияние является частью метода гибридизации соматических клеток. Моноклональные антитела абсолютно специфичны по отношению к антигену и не дают перекрестной реактивности. Однако их не всегда можно применять на тканях, фиксированных, например, в формалине.
Популярность иммунопероксидазного метода связана, в основном с его простотой и доступностью. Существует множество коммерческих наборов (kits) сывороток к различным антигенам, специфичным для тканей или опухолей и получившим название маркеров. Термин «маркер», как бы приравненный к понятию «признак», указывает на диагностическое значение этих антигенов при выявлении и типировании тканей (табл. 1.2) или патологических процессов в них. Выгоды применения иммунопер-оксидазных реакций объясняются высокой чувствительностью (по сравнению с иммунофлуоресценцией ПАП-метод чувствительнее в 1000 раз, а ABC-метод — в 10 ООО раз), относительной стойкостью, возможностью применения некоторых реакций на депарафинированных срезах, прошедших и фиксацию, и проводку через спирты.
Методы молекулярной биологии. В хорошо оснащенных па-тологоанатомических отделениях и научно-исследовательских институтах для прижизненной диагностики применяют методы молекулярной биологии: проточную цитометрию и технику гибридизации in situ, т.е. на месте, на гистологическом срезе. Первый метод необходим для количественного анализа содержания ДНК в клетках опухолей и других патологических субстратов.
 С этой целью исследуемый кусочек нефиксированной ткани с помощью ферментов подвергают дезагрегации, т.е. разъединению и размельчению до отдельных клеток. Затем в специальной установке (схема 1.2) поток суспензии изолированных клеток толщиной в 1 клетку, окруженный обволакивающей жидкостью, проходит через считывающий лазерный пучок. Недавно научились изолировать ядра^леток и проводить их в более узких потоках, что усовершенствовало и без того точный анализ.
С этой целью исследуемый кусочек нефиксированной ткани с помощью ферментов подвергают дезагрегации, т.е. разъединению и размельчению до отдельных клеток. Затем в специальной установке (схема 1.2) поток суспензии изолированных клеток толщиной в 1 клетку, окруженный обволакивающей жидкостью, проходит через считывающий лазерный пучок. Недавно научились изолировать ядра^леток и проводить их в более узких потоках, что усовершенствовало и без того точный анализ.
Свечение, испускаемое люминесцирующими клетками, предварительно помеченными флуорохромами, например, по непрямой методике, попадает на фотоиндикаторы, с которых сигнал определенной силы подается на компьютер. Сигнал, перемещающийся с компьютера, заряжает жидкостный поток, вызывая его отклонения на соответствующую величину согласно величинам искомых параметров клеток (например, количества ДНК) при их прохождении между заряженными электродами. Так осуществляется сортировка, а отсортированные клетки направляются в разные емкости. Размеры клеток или изолированных ядер определяют в компьютере после анализа переднего углового светового рассеивания, которое прямо пропорционально этим размерам. Для параллельного определения содержания в клетках ДНК и РНК клеточную суспензию окрашивают акридин-оранжем — флуорохромом, который окрашивает ДНК в зеленый, а РНК — в оранжево-красный цвет.
Схема 1.2. Проточная цитометрия с сортировкой клеток
Обволакивающая, жидкость
Поток суспензии
 | |||
 | |||
Электроды
USL2SJ Ш -
<5(g(5 to'
Емкости
С помощью гибридизации in situ достигается совмещение генетического материала (фрагментов ДНК, генов) in vitro на основе комплементарности, т.е. взаимного соответствия, например, пуриновых или пиримидиновых оснований у нуклеиновых кислот. Этот метод применяется в основном в трех областях патологии: для идентификации по геному микробов или вирусов, находящихся в тканях или жидкостях; для изучения генома при его врожденных нарушениях; при диагностике опухолей, в частности для распознавания вирусных онкогенов. Есть множество модификаций метода.
Очень популярна полимеразная цепная реакция, которая осуществляется прямо на гистологических срезах. Вначале проводят денатурацию исследуемой ДНК, т.е. разъединение двух ее спиральных нитей и получение одной из них в изолированном состоянии. Затем наслаивают другую, инородную нить (чаще РНК), меченную флуорохромом или ПАП-комплексом. Молекулярная структура этой нити, т.е. последовательность ее оснований, заведомо известна. Если, например, имеется комплемен-тарность с исследуемой нитью (взаимное соответствие оснований; см. главу 8); то красящая реакция на гистологическом препарате положительна, а строение этой нити становится известным.
Исследование хромосом. Во многих современных патолого-анатомических отделениях и научно-исследовательских институтах проводят хромосомный анализ, позволяющий определять отклонения в генетическом аппарате (геноме) клеток, имеющие врожденный или приобретенный характер (хромосомы — прерывистые единицы генома, состоящие из ДНК и белков). Этот анализ приобретает особое значение при распознавании и изучении опухолей, различные варианты которых сопровождаются вполне специфическими, маркерными перестройками или аберрациями хромосом. Для этого прижизненно взятую ткань культивируют, т.е. выращивают на искусственных средах. Такой метод культивирования позволяет путем пересевов и отбора клеток добиться получения культуры клеток одного тканевого типа и даже одного клона, т.е. линии, происходящей от одной стволовой клетки. Сейчас научились культивировать практически любые ткани, однако чаще всего культивируют кровь, костный мозг и фибробласты (последние сохраняют жизнеспособность и пригодность для исследования после взятия с фасций трупа, например fascia lata, в течение 2—3 сут после смерти).
Основные этапы хромосомного анализа на примере исследования лимфоцитов крови состоят в следующем. В культуру ге-паринизированной крови (гепарин — антикоагулянт) добавляют фитогемагглютинин, стимулируя Т-лимфоциты к трансформации в бласты (менее зрелые формы, способные к митозу и делению). Через 2—3 сут инкубации в культуру вносят колхицин для задержки митозов на стадии метафазы у делящихся лимфоцитов. Именно в метафазе хромосомы как бы распластываются, что удобно для изучения. Затем клетки переносят на предметное стекло, фиксируют и окрашивают, чаще всего по методу Гимзы (G.Giemsa). В результате в каждой паре хромосом выявляются светлые (неокрашенные) и темные (окрашенные) полосы (bands), поэтому метод называют бэндингом хромосом. Расположение полос в нормальном кариотипе (наборе хромосом) высокоспецифично для каждой пары хромосом, и диаграммы (карты) бэндинга в норме хорошо известны. Основную символику, часто встречающуюся в литературе по патологии кариоти-па, мы рассмотрим в главе 8. Здесь же отметим, что короткие плечи хромосом обозначают буквой р, длинные — буквой q. В каждом плече выделено по нескольку сегментов и подсегмен-тов. Удлинение или укорочение плеч обозначаются знаками «+» или «—», которые ставят сразу после буквы, относящейся к какому-либо плечу. При патологии возникают различные качественные и количественные аберрации, как внутрихромосомные, так и межхромосомные. К ним относятся делеция (del), т.е. утрата генов, подсегментов и даже целых сегментов хромосом; формирование кольцевых хромосом (г), появляющихся при соединении обломков хромосом; инверсия (i, inv), возникающая вследствие двух разрывов, причем перед воссоединением частей хромосом сегмент, находящийся между разрывами, поворачивается на 180 градусов; транслокация (t) (реципрокная транслокация характеризуется обменом, т.е. взаимным перемещением генетического материала с хромосомы на хромосому внутри генома, нереципрокная — также переносом материала, но в одну сторону, с одной хромосомы на другую).
Приведем примеры обозначения некоторых аберраций. Так, делеция длинного плеча хромосомы 1-й пары ниже ее сегмента q34 символизируется как del (1) (q34), а транслокация части материала длинного плеча той же хромосомы на длинное плечо хромосомы 19-й пары — как t (1; 19) (q34; qll), или, проще, t (lq—, 19q+). Количественные аберрации хромосом тоже имеют специальные обозначения. Назовем основные: увеличение количества хромосом в нормальном диплоидном наборе (триплои-дия, тетраплоидия, полиплоидия), наличие недостаточного или избыточного количества отдельных хромосом или их фрагментов (моносомия, трисомия).
Хромосомный анализ относится к экономически дорогим методам и потому применяется нечасто.
Электронная микроскопия. В ходе диагностических исследований на материале, взятом при жизни больного, нередко используется электронная микроскопия — трансмиссионная (в проходящем пучке, подобно светооптической микроскопии) и сканирующая (снимающая рельеф поверхности). Первую применяют чаще, особенно для изучения в ультратонких срезах ткани деталей строения клеток, выявления микробов, вирусов, отложений иммунных и других комплексов и др. Основные этапы обработки материала следующие.
Только что иссеченный маленький кусочек ткани диаметром 1—1,5 мм немедленно фиксируют в глутаральдегиде или другом фиксаторе, затем в четырехокиси осмия. После проводки материал заливают в специальные эпоксидные смолы или другую плотную среду. Ультратонкие срезы, нарезанные в ультрамикротомах, контрастируют (окрашивают), помещают на специальные сетки и исследуют в трансмиссионном электронном микроскопе.
Ультраструктурное исследование стоит очень дорого, однако нередко применяется в онкоморфологии с диагностической (табл. 1.3) и научной целями.
3. Экспериментальный материал. Исследуя ткани, взятые при жизни или после смерти больного человека, патологоанатом наблюдает изменения в момент изъятия ткани. Что было до того и могло быть после — остается неизвестным. Эксперимент с достаточным количеством лабораторных животных (белых мышей, белых крыс, морских свинок, кроликов, собак, обезьян и др.) позволяет моделировать и изучать болезни и патологические процессы на любом этапе их развития.
Экспериментальной патологией люди занимаются давно. Вначале особенно успешно развивались работы с различными инфекциями, возбудители которых патогенны и для человека, и для лабораторных животных. Затем стали применять реагенты, вызывающие всевозможные изменения в различных органах и
 системах органов. Наиболее важными были опыты с химическими канцерогенами и мутагенами. В настоящее время, несмотря на растущую дороговизну экспериментальных исследований, ими широко пользуются и проводят in vivo (в организме живого животного) и in vitro (в культурах тканей, взятых от животных, пробах крови и т.д.).
системах органов. Наиболее важными были опыты с химическими канцерогенами и мутагенами. В настоящее время, несмотря на растущую дороговизну экспериментальных исследований, ими широко пользуются и проводят in vivo (в организме живого животного) и in vitro (в культурах тканей, взятых от животных, пробах крови и т.д.).
Глава 2.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
