2.1. строение и функции клеток
2.1. строение и функции клеток
В отличие от прокариот клетки эукариот наряду с более сложным строением ядра имеют ряд специфических компарт-ментов в цитоплазме, таких как цитоскелет, мембраносвязан-ные компартменты (в частности, эндоплазматическая сеть), митохондрии и др. Наличие таких внутриклеточных отделов способствует передаче информации, накоплению различных субстанций, повышению реактивности и др. Сильное развитие полупроницаемых липидосодержащих мембран в различных компартментах обеспечивает протекание окислительного фос-форилирования и других процессов, требующих пространственного разделения промежуточных метаболитов. Некоторые компартменты или их части (органеллы) в течение жизни клетки изменяются мало, тогда как другие, например элементы цито-скелета, имеют периоды полужизни, равные лишь нескольким минутам или секундам, и за это время совершают многочисленные функции (табл. 2.1). Эукариоты лишь частично представлены одноклеточными (простейшими) формами, такими как амебы, инфузории и т.д., а в большинстве своем это сложные многоклеточные организмы. Так, в состав тела человека входит около 14 млрд клеток. Напомним главные элементы строения и функции этих клеток.
Ядро является крупнейшим компартментом клетки и центральным хранилищем информации. Различные системы контроля обеспечиваются через его взаимодействие с цитоплазмой. Ядро заключено в оболочку, состоящую из двух мембран, пронизанных многочисленными отверстиями (ядерными порами) (схема 2.1). Поры обеспечивают прохождение молекул белков и нуклеиновых кислот, которыми обмениваются ядро и цитоплаз
ма. Форма ядра стабилизируется группой полипептидов (лами-ны А, В, С), имеющих некоторое сходство с фиброзными белками или промежуточными филаментами, о которых речь пойдет ниже. Ламины связаны с белками внутренней мембраны ядерной оболочки и на ее ядерной стороне формируют электронно-плотный слой — ядерную пластину, которая поддерживает мембрану и контактирует с хромосомами и ядерными РНК.
Внутри ядер клеток человека содержится 46 хромосом. Каждая из них состоит из одной молекулы ДНК общей длиной около 5 см, компактно упакованной в сложной комбинации с положительно заряженными структурными белками (гистона-ми) и формирующей нитчатые структуры (нуклеосомы). Тесно упакованные нуклеосомы образуют электрон но-плотный гете-рохроматин, который, по-видимому, не участвует в транскрип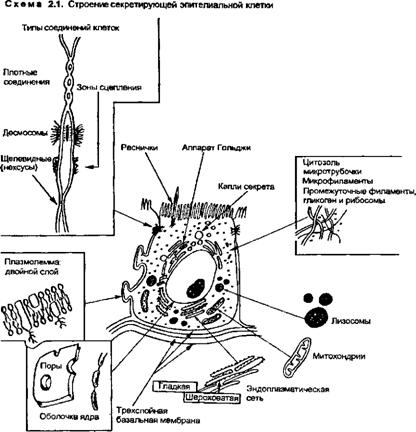
ции (синтезе РНК на матрицах ДНК) и часто концентрируется на периферии ядра. Транскрипция РНК, напротив, происходит в более свободно распределенном и электронно-светлом эухро-матине. Транскрипты РНК упаковываются в рибонуклеопроте-иновые комплексы, что способствует их последующему процес-сингу. В ходе процессинга определенные нуклеотидные последовательности РНК удаляются, а оставшиеся «сращиваются» (сплайсируются). После завершения сплайсинга упаковывающие белки удаляются и молекулы РНК переносятся из ядра в цитоплазму (мРНК).
Размещение хромосом внутри ядра, по-видимому, не является случайным, беспорядочным. В пользу этого говорит хотя бы тот факт, что гены интерфазных хромосом, необходимых для образования ядрышка, собираются вместе в определенной области ядра.
Несмотря на то что в гаплоидном наборе хромосом, содержащем по одной копии каждой аутосомы (неполовой хромосомы) и лишь по одной половой хромосоме, каждой клетки содержится информация об устройстве всего организма, эта информация может правильно интерпретироваться и реализовываться только при взаимодействии с цитоплазмой. При контроле за экспрессией (выражением, реализацией программы) генов ядро и цитоплазма действуют на взаимозависимой основе. Необычность ядерного компартмента состоит в том, что его структура временна: при каждом делении клетки ядерная оболочка исчезает, а затем снова восстанавливается. Очевидно, структуры и функции ядра сохраняются или охраняются наилучшим образом с помощью ядерной мембраны, ибо их изменение или повреждение опасно для жизни организма. С другой стороны, ядерный компартмент обеспечивает эффективный сплайсинг, позволяющий одному гену детерминировать образование нескольких различных белков.
Плазмолемма (цитоплазматическая мембрана) является сложной структурой, разграничивающей внутрии внеклеточные пространства. Через плазмолемму осуществляется прохождение — транспорт различных молекул, регулируемое структурами, выполняющими роль насосов и каналов. Эта мембрана обеспечивает взаимодействие с прилежащими клетками, она может воспринимать раздражение электрическими зарядами. Плазмолемма содержит множество рецепторов, в частности для гидрофильных сигнальных молекул. Таким образом, кроме транспортной, она выполняет еще и другую важнейшую функцию — рецепторную.
Как и внутриклеточные мембраны, плазмолемма состоит из двойного слоя липидных молекул, в которые заключены мембранные белки (см. схему 2.1). В некоторых участках белки вмонтированы в строго определенном порядке, в других местах — произвольно. Двойной фосфолипидный слой плазмолем-мы отличается гибкостью и имеет жидкое состояние. Он соответствует любой форме, которую принимает двигающаяся клетка, и способствует перераспределению и различным взаимодействиям белков в составе мембраны. Этот слой состоит из наружных гидрофильных полярных групп (см. схему 2.1) и центральных гидрофобных (хвостовых) частей, построенных из длинных цепей углеводов. Гидрофобные части непроницаемы для гидрофильных молекул. Свойства белков плазмолеммы в значительной мере определяют свойства этой мембраны и в общих чертах как бы маркируют специфичность фенотипа или тип дифферен-цировки клетки. Мембранные белки различаются по локализации, строению и функции. Внутренние белки встроены в двойной липидный слой, либо пронизывая его полностью (трансмембранные протеины), либо выступая из него на его наружной или внутренней поверхности. Периферические мембранные белки связаны более свободно и удерживаются на своих местах с помощью взаимодействия с внутренними белками или кова-лентной связи с гидрофобными группами молекул, такими как гликолипиды (ковалентная связь осуществляется парой электронов, находящейся в общем владении двух атомов, образующих связь). Многие мембранные белки гликозилированы, в частности, на своих внеклеточных (наружных) доменах (участках аминокислотной последовательности). При этом у разных клеток углеводные группы (цепи) различаются по составу (см схему 2.1), но их функции остаются пока неясными.
Внутренний и внешний листки плазмолеммы различаются по составу входящих туда фосфолипидов. Внутренний листок представлен главным образом фосфатидилинозитом, фосфати-дилэтаноламином и фосфатидилсерином, а внешний — фосфа-тидилхолином, сфингомиелином и гликолипидами. Кроме своей структурной роли, фосфолипиды, в частности фосфати-дилинозит, участвуют также в сигнальной трансдукции (переносе генетического материала), о которой речь пойдет дальше.
Свойства жидкости фосфолипидного двойного слоя плазмолеммы влияют на подвижность и иногда на нормальные функции интегральных (неотъемлемых) мембранных белков, например, с помощью ограничения структурных изменений. Так, изменение активности ионного насоса может повлечь за собой смещение трансмембранного ионного распределения, используемого для передачи нервных импульсов. Многие анестетики действуют путем возможного видоизменения липидного окружения каких-либо определенных белков. Жидкое состояние плазмолеммы регулируется холестерином, который, в частности, делает клетки менее чувствительными к температурным колебаниям. Поэтому плазмолемма поддерживает свое жидкое состояние даже при низких температурах.
Значительный дефект структуры плазмолеммы несовместим с выживанием клетки, и потому ее повреждение часто приводит к гибели клетки. Повреждение двойного липидного слоя бактериальными ферментами.(например, лецитиназой, вырабатываемой Clostridium perfringens — возбудителем анаэробной гангрены), расщепляющим действием активированных комплементов (см. главу 4) или воздействием цитотоксических Т-лимфоцитов (см. главу 5) способствует вымыванию мелких молекул и проникновению через плазмолемму воды. В итоге клетка набухает и гибнет.
Известны также генетические повреждения цитоплазмати-ческой мембраны. Нарушение чрезмембранного транспорта связано с отсутствием специфических мелких молекул транспортных белков. При наследственной болезни Хартнупа (E.Hartnup) развивается дефект транспорта аминокислот через эпителий кишки и почечных канальцев, что приводит к уменьшению всасывания, в частности триптофана, и ненормальному выделению аминокислот с мочой. У больных мышечной дистрофией (псевдогипертрофической миопатией) Дюшенна (G.B.A.Duchenne), являющейся сложным рецессивным заболеванием, связанным с Х-хромосомой (см. главу 24), тоже возникает дефект мембранного белка, в данном случае — дистрофи-на. Мальчики с такой патологией нередко умирают в юношеском возрасте от прогрессирующего мышечного истощения и дыхательной недостаточности.
Цитосклелет. Важную роль в обеспечении механической прочности клетки выполняет набор микрофиламентов, микротрубочек и промежуточных филаментов, составляющих цитос-келет (филаменты — нитчатые или нитчато-волокнистые структуры). Микрофиламенты и микротрубочки участвуют в двигательной функции и вместе с тем являются структурными элементами. Промежуточные филаменты поддерживают структуру клетки и противостоят ее растяжению. Белки цитоскелета связаны с интегральными мембранными протеинами с помощью различных субплазмолеммальных (подмембранных) белков, таких как винкулин, анкирин и спектрин. Строение цитоскелета вначале изучали на примере эритроцитов, претерпевающих значительные деформации при прохождении через микроциркуля -торное русло. Изменения цитоскелета этих клеток встречаются при таких нарушениях, как наследственный сфероцитоз (глава 12), когда форма эритроцитов изменена из-за отсутствия спектрина. Такие ненормальные эритроциты не могут перенести деформацию в селезенке. Они застаиваются в тяжах красной пульпы селезенки, период их жизни уменьшен, и это приводит к анемии. Белки, подобные мембранным структурным протеинам, встречаются не только в эритроцитах, но и в других типах клеток, включая эндотелий
Микрофиламенты в клетке представлены нитеобразным актином, являющимся линейным полимером глобулярного актина, и миозином. Микрофиламенты нитеобразного актина сходны с филаментами актина поперечнополосатых мышц, однако не связаны с тропонином и лишь иногда связаны с тро-помиозином. Миозин есть почти во всех клетках позвоночных и всегда находится в сократительных пучках, образуемых в цитоплазме актиновыми филаментами скелетных мышц; он связывается с микрофиламентами в форме наконечника копья или стрелы, обозначая внутреннюю полярность полимера, существенную для движения.
Микрофиламенты разделены на две группы: в виде сетчатых структур, скрепленных с плазмолеммой с помощью спектрина и анкирина и обеспечивающих многие механические свойства клеточной поверхности; в виде пучков, формирующихся актин-связывающими белками, в частности фимбрином и фасцином. Прикрепление к плазматической мембране позволяет пучкам микрофиламентов передавать тянущее усилие на субстрат — клетку или внеклеточный матрикс. Актиновые нити способны к линейному сокращению посредством скольжения филаментов, лежащих рядом и параллельно друг другу. Пучки параллельных филаментов актина поддерживают микроворсины кишечного эпителия, фиксируясь с помощью молекул спектрина в апикальной части клеток и молекул мини-миозина на плазматической мембране. Актин — один из наиболее распространенных клеточных белков (на его долю приходится 8—14 \% массы всего белка организма). Он очень хорошо сохраняется, поскольку взаимодействует с многочисленными протеинами. Дефекты актина пока не изучены.
Микротрубочки — вторая из трех главных групп нитевидных элементов цитоскелета. Они представляют собой линейные полимеры, построенные из гетеродимеров тубулина, образованных двумя прочно связанными глобулярными субъединицами (аи р-тубулины). Общая длина актиновых филаментов по меньшей мере в 30 раз больше общей длины микротрубочек. Это отражает фундаментальную разницу в структурной организации и функциях этих двух цитоскелетных полимеров. Если актиновые нити образуют соединенные сшивками сети и небольшие пучки на периферии цитоплазмы, то микротрубочки, как правило, представлены отдельными нитями, расходящимися в различные стороны через цитоплазму из области вблизи ядра. Различают три класса микротрубочек — цитоплазматичес-кие, веретеновидные и осевые.
Цитоплазматические микротрубочки происходят из центра, организующего микротрубочки — центриоли, которая находится в перицентриолярной зоне цитоплазмы (см. схему 2.1). Подобно микрофиламентам, эти микротрубочки имеют полярность. Недавно были открыты двигательные системы, связанные с микротрубочками, и показана их роль в стабилизации формирования клеточных органелл. Оказалось, что в этом процессе участвуют две различные «моторные» молекулы — кине-зин, транспортирующий органеллы к периферическим концам микротрубочек, и цитоплазматический динеин, несущий их обратно к центру, организующему микротрубочки. Разрушение системы микротрубочек колхицином приводит к рассредоточению аппарата Гольджи (C.Golgi), разрушению эндоплазмати-ческой сети, активному перераспределению промежуточных филаментов в направлении к перинуклеарной зоне, в котором участвует актин. Сходные механизмы участвуют в транспорте материала от главного тела нейрона вдоль аксонов (аксоплазма-тический поток) и обратно. Таким образом, нормальная организация цитоплазмы клеток зависит от активности указанных моторных систем.
Веретеновидные микротрубочки имеют существенное значение для митоза (деление клетки) и мейоза (деление гамет, т.е. половых клеток). Разрушение этих трубочек, как иногда говорят, веретена, с помощью колхицина приводит к остановке клеточного деления на стадии метафазы.
Осевые микротрубочки приобретают устойчивость при взаимодействии с другими белками и являются необходимой частью реснитчатой моторной системы. Повреждение осевого динеина сопровождается синдромом неподвижных реснитчатых структур (синдромом Картагенера, M.Kartagener). Оно приводит к мужскому бесплодию из-за неподвижности сперматозоидов, а также к инфекциям органов дыхания из-за неподвижности ресничек в апикальных отделах призматических клеток респираторного эпителия.
Промежуточные филаменты представляют собой группу волокнистых белков, выполняющих структурную роль или роль белков, препятствующих растяжению клетки. Несмотря на то что имеется несколько различных групп тканеспе-цифичных промежуточных филаментов (табл. 2.2) с разной молекулярной массой и аминокислотной последовательностью, все они имеют гомологичный (идентичный по составу) домен, который при димеризации белка образует жесткую структуру из обвивающих друг друга спиралей. Такие спирали складываются в большие пучки и формируют филаменты диаметром в 8— 10 нм, промежуточные по размеру между микрофиламентами и толстыми филаментами (миозин). Организация промежуточных микрофиламентов зависит от взаимодействия с микротрубочками и также может определяться их взаимодействием с цитоплаз-матической мембраной. Так, в эпителиальных клетках цитоке-ратиновые филаменты присоединяются к плазмолемме в зоне нахождения десмосом, о которых будет сказано дальше. Клетки тканей различных типов содержат разные промежуточные филаменты, которые часто выявляют с помощью иммуногистохи-мических реакций (см. главу 1). Нередко иммуногистохимичес-кие маркеры (см. табл. 1.2 в главе 1) помогают патологоанатому установить тип (направление) тканевой дифференцировки злокачественной опухоли (см. главу 7). Злокачественные эпителиальные опухоли (карциномы) обычно содержат молекулы цито-кератинов, а злокачественные неэпителиальные новообразования (саркомы) — виментин (см. табл. 1.2 и 2.2). И все же добавочная экспрессия (коэкспрессия) промежуточных филаментов, не соответствующих данному типу клеток, может встречаться и в тех, и в других новообразованиях, например цитокератина — в некоторых саркомах и виментина — в карциномах.
Патологический процесс может повреждать промежуточные филаменты. При алкогольных поражениях печени следствием такого поражения является формирование в цитоплазме набухших гепатоцитов изолированных эозинофильных включений, известных как тельца (гиалиновые тельца) Маллори (F.B.Mal-lory, см. главу 17). Повреждение цитоскелета может вызывать набухание или баллонизацию клеток. При синдроме Кушинга
 (H.W.Cushing; синдром гиперфункции коры надпочечников) в цитоплазме кортикотропоцитов аденогипофиза появляются гиалиновые включения Крука (A.C.Crooke, см. главу 23). Появление пучков или сплетений нейрофибрилл при болезни Альцгей-мера (A.Alzheimer; разновидность пресенильного слабоумия) и синдроме Дауна (J.Down; синдром врожденной трисомии 21-й пары хромосом, см. главу 26) трактуют как последствия повреждения цитоскелета.
(H.W.Cushing; синдром гиперфункции коры надпочечников) в цитоплазме кортикотропоцитов аденогипофиза появляются гиалиновые включения Крука (A.C.Crooke, см. главу 23). Появление пучков или сплетений нейрофибрилл при болезни Альцгей-мера (A.Alzheimer; разновидность пресенильного слабоумия) и синдроме Дауна (J.Down; синдром врожденной трисомии 21-й пары хромосом, см. главу 26) трактуют как последствия повреждения цитоскелета.
Передвижение клеток. Движение клетки, вызывающее подчас изменение ее формы (например, при миграции или поглощении каких-либо частиц), зависит от функции актиновых микрофиламентов и в некоторых случаях — миозина. Передвижение клеток лежит в основе многих процессов при закладке и формировании тканей и органов, воспалении, заживлении, иммунной защите, распространении злокачественных опухолей и росте новообразованных капилляров (ангиогенез). Существует два этапа в перемещении тела клетки. Вначале происходит выпячивание части клетки в том направлении, куда она будет двигаться, а затем сокращение и подтягивание оставшейся части к первой из них. Первый этап, по-видимому, почти полностью реализуется за счет функции филаментов актина, поперечно связанных с актинсвязывающими белками — талином, винку-лином, а-актином. Чтобы произошло движение, требуется временное прикрепление клетки к субстрату, в котором она находится. При этом важен именно кратковременный характер прикрепления, так как необратимая адгезия (прилипание, прикрепление) будет фиксировать клетку на месте. Однако если при-
2. Пальцев, т1.
33
крепление не является адекватным, движение клетки не состоится.
Так, фибробласты образуют дискретные (состоящие из разных реакций и частей) контакты с субстратом своего окружения и могут оказывать на него весьма сильное местное воздействие. При заживлении ран миофибробласты действуют подобно лебедкам, стягивая воедино субстрат, с которым произошли контакты, и вызывая контракцию (сужение, сжатие) раны (см. главу 4). И хотя это уменьшает площадь раневого дефекта, имеются потенциально вредные воздействия, такие как контрактуры после ожогов или контракция стекловидного тела глаза, вызывающая отслойку сетчатки (см. главу 26). Клетки, более инва-зивные, чем фибробласты, т.е. обладающие еще большими возможностями для проникновения через субстрат, не оказывают на него сильного местного давления и имеют свойства к адгезии скорее диффузного, чем местного характера. Способность к диффузной (распространенной) адгезии позволяет клетке продвигаться через субстраты слабой жесткости, например через поверхности других клеток. Если клетка не способна продвигаться сквозь окружающие ее клетки, то она пребывает в состоянии контактного торможения. Утрата контактного торможения процесса передвижения дает возможность клетке освободиться от позиционного контроля и стать инвазивной, т.е. способной к передвижению в субстрате и матриксе микроокружения. Конечно же, далеко не все инвазивные клетки являются опухолевыми, злокачественными. Вот два примера очень частой неопухолевой клеточной инвазии: полиморфно-ядерные ней-трофильные лейкоциты способны к обширной и дистантной инвазии разных тканей при воспалении (см. главу 4), а эпители-оциты могут проходить через территорию, занятую фиброблас-тами, в ходе заживления ран.
Про дефекты основных движущих систем клетки известно немного. Главные проблемы связаны с системами контроля, регулирующими поведение, в частности, взаимоотношения с другими клетками. Эти важные системы цитоскелета настолько необходимы для многочисленных функций клетки, включая митоз и передвижение, что любое их серьезное нарушение может быть несовместимым с жизнью и развитием клетки, ткани, организма. Итак, если существуют какие-либо дефекты, то они, очевидно, трудноуловимы и скорее касаются систем контроля, а не структур цитоскелета. Примером служит изменение фиброблас-тов в культуре ткани, трансформированных чувствительным к температуре вирусом саркомы Рауса (F.P.A.Rous). В течение 20 мин после перемещения этих клеток в температурные условия, разрешающие вирусную трансформацию, организация системы микрофиламентов фибробластов полностью изменяется. Параллельно клетки малигнизируются, т.е. озлокачествляются. Таким образом, изменения в двигательном поведении злокаче-
ственных клеток составляют важное звено в обеспечении их инвазии и метастазирования.
В отличие от клеточной инвазии, представляющей собой лишь проникновение клеток в субстрат и матрикс микроокружения, а также их передвижение, инвазия злокачественных опухолевых клеток — это более сложный и многокомпонентный патологический процесс, протекающий с большим повреждением элементов микроокружения (см. главу 7).
4. Мембраносвязанные внутриклеточные компартменты. Цитоплазма клетки содержит ряд мембраносвязанных компарт-ментов, о которых в настоящее время известно, что они являются частью единой связанной системы, включающей в себя эндо-плазматическую сеть, аппарат Гольджи и лизосомы. Внутренние части каждой из этих органелл формируют отдельные компартменты, не связанные с цитозолем (белковый раствор, наполняющий цитоплазму, в котором размещены органеллы), и топологически равнозначные наружным частям органелл (топологические свойства фигур не изменяются при любых деформациях, кроме разрывов и склеиваний) (схема 2.2). Эти мембранные компартменты являются активно действующими единицами с постоянным взаимным обменом мембранами. Такой обмен приводит к восстановлению мембранных белков через внутренние везикулы. При этом материал может поступать снаружи в цитоплазматические везикулы (эндоцитоз) или же содержимое везикул может освобождаться в наружные части клетки (экзо-цитоз). Наличие конкретного набора мембранных белков обусловливает функциональную способность мембраны.
Белки, предназначенные для экспорта, в большинстве случаев синтезируются на рибосомах, связанных с шероховатой эн-доплазматической сетью (сборка аминокислот в полипептидную цепь по аналогу мРНК — это трансляция, она выполняется рибосомами — специальными органеллами в виде мелких частиц, состоящими из РНК и белка). Часть белков синтезируется в свободно лежащих рибосомах. Доставка белков в пространство цистерн шероховатой эндоплазматической сети начинается еще до того, как полипептидная цепь полностью сформирована, т.е. он происходит одновременно с трансляцией. Специфическое связывание с шероховатой эндоплазматической сетью обусловлено механизмом распознавания, основанным на наличии сигнального пептида. Частичный (неполный) перевод белка в пространство цистерн эндоплазматической сети приводит его в состояние интегрального (цельного) мембранного протеина. После перемещения в указанное пространство белок частично гликозилируется и упаковывается в транспортные пузырьки, сливающиеся с ближайшей цистерной аппарата Гольджи, где гликозилирование завершается.
Этот процесс на молекулярном уровне известен только для лизосомальных гидролаз. Они содержат маннозу-6-фосфат, ко-
2*
35
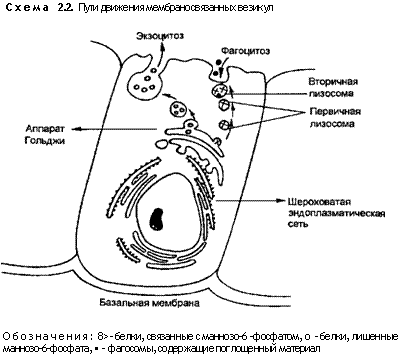 торый связывается с рецепторами, группирующимися на мембранах аппарата Гольджи. Отделенные от остальных белков ли-зосомальные гйдролазы вместе с рецепторами собираются в покрытых клатрином окаймленных транспортных пузырьках, которые быстро теряют свою кайму и сливаются с эндолизосома-ми. Лизосомальные ферменты в эндолизосоме отделяются от белка-рецептора маннозо-6-фосфата. Освобожденный рецептор восстанавливает свою структуру и возвращается в мембраны аппарата Гольджи, возможно, в составе окаймленных пузырьков, для повторного (челночного) использования. Протеины, лишенные связи с маннозой-6-фосфатом, направляются в другие везикулы либо для сохранения, либо для немедленной секреции из клетки (см. схему 2.2).
торый связывается с рецепторами, группирующимися на мембранах аппарата Гольджи. Отделенные от остальных белков ли-зосомальные гйдролазы вместе с рецепторами собираются в покрытых клатрином окаймленных транспортных пузырьках, которые быстро теряют свою кайму и сливаются с эндолизосома-ми. Лизосомальные ферменты в эндолизосоме отделяются от белка-рецептора маннозо-6-фосфата. Освобожденный рецептор восстанавливает свою структуру и возвращается в мембраны аппарата Гольджи, возможно, в составе окаймленных пузырьков, для повторного (челночного) использования. Протеины, лишенные связи с маннозой-6-фосфатом, направляются в другие везикулы либо для сохранения, либо для немедленной секреции из клетки (см. схему 2.2).
Нарушение этого механизма приводит к редкому метаболическому заболеванию — муколипидозу II с фибриллярными и гранулярными включениями в мембраносвязанных вакуолях фибробластов и других мезенхимальных клеток (см. главу 9). У больных, гомозиготных для этого рецессивного заболевания, обнаруживают высокий уровень лизосомальных ферментов в различных внеклеточных жидкостях. При этом отмечают дефицит или отсутствие ферментов в самих лизосомах. Все это обусловлено отсутствием фермента, который присоединяет маркер распознавания маннозы-6-фосфата к гидролазам. Поэтому последние остаются не упакованными в лизосомы и направляются в секреторные везикулы. Возможно, сходные способы соединения действуют и в других компартментах. В группу этих болезней входит дефицит сц-антитрипсина, при котором замещение единственной аминокислотной группы сопровождается накоплением агантитрипсина в шероховатой эндоплазматической сети гепатоцитов. Такое накопление белка в виде мелких шариков в цитоплазме печеночных клеток можно увидеть при окраске гистологических срезов в малиново-красный цвет при ШИК-реакции, а также специфическими антителами (иммуногистохи-мическая реакция, см. главу 1).
Мембраносвязанные везикулы избирательно нацелены на конкретные зоны плазмолеммы. В эпителиальных клетках секреторные продукты, такие как муцин (слизь) или пищеварительные ферменты, освобождаются с апикальной поверхности клетки, в то время как компоненты базальной мембраны — ла-минин и коллаген IV типа откладываются на базальной поверхности. Таким образом, существует два отчетливых мембранных домена — апикальный и базолатеральный, каждый с разными функциями и различными интегральными протеинами. Диффузия мембранных белков между этими доменами ограничена плотными контактами клеток (см. схему 2.1).
На случай экстренного запроса внутри клетки накапливается немало секреторных продуктов. Например, по получении соответствующего гормонального сигнала ацинарные клетки поджелудочной железы освобождают пищеварительные ферменты, которые сохраняются в форме неактивных предшественников (проферменты) в везикулах накопления (гранулы зи-могена). При слиянии мембраны везикулы с апикальной частью плазмолеммы содержимое везикулы освобождается в пространство ацинусов, где путем ферментного расщепления предшественники превращаются в активные формы. Перевод везикул в апикальную зону клетки является активным процессом и связан с регуляцией содержания внутриклеточного кальция.
Отдельно следует сказать об эндоцитозе, опосредованном рецепторами. Это процесс, при котором специфические субстанции связываются с рецепторами клеточной поверхности, а затем перемещаются в цитоплазму, что позволяет эффективно использовать специфические макромолекулы. Молекулы, которые связываются с рецепторами, называются лигандами. В зонах переноса макромолекул в цитоплазму обнаружены углубления, или ямки, имеющие электронно-плотные покрытия на внутреннем слое плазмолеммы, богатые различными белками, включая клатрин. Когда происходит связывание соответствующих лигандов с рецепторами, ямки в плазмолемме, покры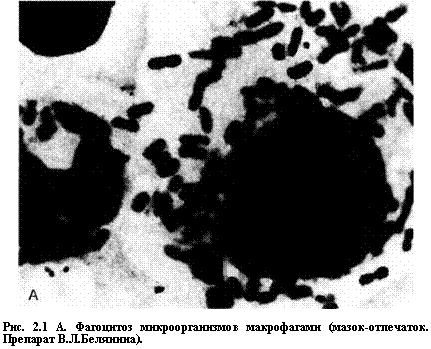
тые изнутри клатрином, быстро втягиваются в цитоплазму и превращаются в покрытые везикулы.
Характерным примером эндоцитоза является работа рецеп-торной системы липопротеина низкой плотности (ЛПНП). Ген этой системы находится в хромосоме 19. Поглощение ЛПНП, богатого холестерином, осуществляется путем связывания со специфическим рецептором. Рецепторно-лигандные комплексы втягиваются в везикулы, которые сливаются друг с другом и формируют более крупные везикулы — эндосомы. Последние в свою очередь сливаются с первичными лизосомами, формируя вторичные лизосомы, в которых осуществляется гидролиз эфиров холестерина. В результате холестерин становится пригодным для синтеза новых мембран, в то время как рецепторы ЛПНП восстанавливаются на клеточной поверхности. При наследственной гиперхолестеринемии (см. главу 8) имеется недостаточность системы поглощения, поэтому уровень холестерина крови повышается и атеросклероз развивается в раннем возрасте (см. главу 11). У таких больных обнаружены различные дефекты генетической природы: частичное или полное отсутствие рецепторов ЛПНП, недостаточность связывания ли-гандов или втягивания в цитоплазму рецепторно-лигандного комплекса.
Рис. 2.1 Б. Вторичная лизосома (фагосома) в цитоплазме макрофага, содержащая бактерии. Электронограмма (негатив В.Л.Белянина).
Лизосомы ограничены однослойной мембраной и содержат ряд гидролитических ферментов, которые, как уже говорилось, направляются в этот компартмент путем прикрепления к ман-нозе-6-фосфату. Транспорт материала в лизосомы может осуществляться с помощью уже описанного эндоцитоза, аутофагии и фагоцитоза. Аутофагия — процесс захвата отработанных частей самой клетки, в результате чего образуется аутофагосома, а после слияния с лизосомой — аутофаголизосома. Фагоцитоз осуществляется только специализированными для захвата больших частиц и микроорганизмов клетками — нейтрофилами и макрофагами (см. главу 4), в цитоплазме которых образуются фагосомы. Фагосома превращается в фаголизосому после слияния с лизосомой. Большинство лизосомальных ферментов обладает максимальной активностью при кислом рН. Они не активны, пока лизосомы не набухают или не сливаются с первичными фагосомами (рис. 2.1, А и Б). В результате слияния лизосомы и фагосомы происходит активация кислых гидролаз (см. схему 2.2).
Повреждение лизосом связано с несколькими причинами. Например, их проницаемость может быть нарушена бактериальными, в частности стрептококковыми, токсинами, или сурфак-тантами (поверхностно-активные вещества) при гипервитаминозе А. Так, вдыхаемые частицы кварца поглощаются макрофагами и частично превращаются в кремниевую кислоту, которая повреждает фосфолипиды лизосомальной мембраны. Это приводит к фиброзу легочной ткани и развитию заболевания из группы профессиональных болезней, которое называется силикозом (см. главу 9). Частицы, слишком крупные для полного их поглощения, могут тем не менее вызывать освобождение лизо-сомальных ферментов непосредственно во внеклеточное пространство. Так, при подагре в синовиальной жидкости находятся длинные игловидные кристаллы урата натрия. Они поглощаются полиморфно-ядерными нейтрофильными лейкоцитами. Последние освобождают лизосомальные ферменты, способствующие развитию тяжелого воспаления в суставах. При порфи-рии (наследственное нарушение обмена пигментов порфиринов и синтеза гема — допигментной части молекулы гемоглобина) поглощенные порфирины вызывают химическое повреждение лизосомальных мембран. Очевидно, освобождение расщепляющих ферментов в цитоплазму в результате повреждения лизосом является повреждающим фактором.
Если клетки не способны к расщеплению какого-либо материала, то он может накапливаться во вторичных лизосомах с постепенным формированием остаточных телец. Примеры заболеваний лизосомального накопления, при которых отмечается недостаток специфических лизосомальных ферментов, обсуждены в главе 9. Совместное культивирование in vitro фибробластов, полученных от больных с болезнями накопления, с нормальными фибробластами приводит к полному восстановлению функций лизосом в пораженных клетках. Кроме того, пересадка тканей могла бы способствовать появлению в тканях реципиента недостающих специфических ферментов. Так, пересадку печени проводят для исправления ферментативных дефектов, в которые вовлечены гепатоциты (например, при болезнях накопления гликогена I и IV типов и гиперлипидемии IV типа).
5. Митохондрии являются главными органеллами для продукции АТФ. Ферменты, обеспечивающие расщепление жирных кислот и пирувата (соли пировиноградной кислоты) и участвующие в цикле лимонной кислоты, находятся в матриксе митохондрий (субстанция, заполняющая органеллу), в то время как ферментные системы, участвующие в окислительном фос-форилировании, распределены в строгом порядке на внутренней мембране митохондрий. Образование АТФ требует создания протонового градиента, действующего через мембрану митохондрий, поэтому их существование в виде закрытого ком-партмента весьма существенно для реализации их функций. Расщепление АТФ служит «двигателем» активного транспорта. Через плазмолемму переносятся протоны (элементарные частицы, образующие вместе с нейтронами ядра атомов) и неорганические ионы. С помощью протонного и ионного насосов создаются электрохимические потенциалы, используемые для параллельного или антипараллельного (против градиента концентрации) транспорта. Несмотря на их обычный цилиндрический вид и длину в 0,5—1 мкм, митохондрии значительно варьируют по форме и могут образовывать сеть с развитыми взаимосвязями.
Митохондрии относятся к полуавтономным органеллам. Они развиваются путем роста и деления предсуществующих митохондрий, имеют собственную ДНК и рибосомы. Многие биологи придерживаются концепции симбиоза, предполагающей, что на ранних этапах эволюции клетки эукариот заселялись бактериями и между ними устанавливался режим симбиоза (взаимоотношения, при которых оба вида совместно регулируют отношения с внешней средой, извлекая обоюдную выгоду). Таким образом, бактериальные митохондрии удовлетворяют энергетические требования клеток-хозяев, в то время как многие митохондриальные белки кодируются ядерной ДНК и синтезируются в цитоплазме. Стоит только этим белкам подвергнуться избирательному транспорту через митохондриальную мембрану, как они претерпевают структурные изменения, предотвращающие их обратный переход через мембрану. Несмотря на то что репликация митохондрий не зависит от деления клеток, она не является полностью неуправляемой. Общее количество митохондрий в клетке — это показатель ее энергетических запросов, а их локализация — индикатор главной зоны потребления АТФ. Обычно активные митохондрии имеют больше крист (гребней), обеспечивающих большую поверхность для распределения дыхательных комплексов (цепь дыхания или цепь транспорта электронов состоит из оксидоредуктаз, которые, будучи интегральными белками внутренней мембраны митохондрий, образуют мультиферментные комплексы).
Функциональные расстройства митохондрий у млекопитающих крайне редки. Так, при наследственных митохондриальных миопатиях (см. главу 26), протекающих с офтальмоплегией (паралич мышц глаз) или без нее, возникают дефекты в дыхательной цепи. Эти дефекты приводят либо к продукции токсинов, тормозящих функции митохондрий, либо к нехватке кислорода, необходимого для окислительного фосфорилирования. Таким образом, клеточный запас АТФ быстро истощается и энергозависимые системы прекращают действовать. Основное значение здесь имеют ионные насосы, такие как натриево-калиево-АТ-Фазный, в плазмолемме, обеспечивающие осмотическое равновесие в клетке. Осмос — диффузия воды через полупроницаемую плазмолемму, которая хорошо пропускает воду, но малопроницаема для растворенных в ней веществ. Поэтому набухание клетки является общим и частым признаком ее повреждения.
6. Цитозоль (гиалоплазма, матрикс цитоплазмы). Мы описали важнейшие компартменты и органеллы клетки, о функциях и морфофункциональных нарушениях которых пойдет речь при рассмотрении патологических процессов. Осталось коротко сказать о цитозоле, составляющем около половины объема эу-кариотической клетки, за вычетом органелл. В состав цитозоля входит множество ферментов промежуточного обмена и свободно лежащие рибосомы, синтезирующие белки. Около половины всех белков, образующихся на свободно лежащих рибосомах, остается в цитозоле в качестве постоянных компонентов. Многие из них претерпевают ковалентные модификации.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
