2.2. межклеточные и клеточно-матриксные взаимодействия
2.2. межклеточные и клеточно-матриксные взаимодействия
В многоклеточном организме взаимодействия между клетками имеют огромное значение. Клетки должны постоянно находиться в контакте друг с другом или с внеклеточным матриксом. Имеется в виду не только механическая связь, но и коммуникационная (передача и обмен информацией). Невозможно рассмотреть виды коммуникаций во всех четырех главных типах тканей — эпителиальной, мезенхимальной, скелетно-мышечной и нервной. Рассмотрим принципы взаимодействий на примере эпителия и соединительной ткани.
1. Эпителиальные ткани состоят из пластов тесно сцепленных клеток. Эти пласты прочно прикреплены к базальной мембране. Эпителиоциты связаны друг с другом с помощью специальных межклеточных соединений, которые можно разделить на три функциональные группы: запирающие соединения, прикрепительные контакты и коммуникационные контакты (см. схему 2.1).
Плотные соединения (запирающие контак-т ы) представляют собой несколько слияний участков плазмо-лемм двух соседних клеток и выполняют не только роль механического соединения клеток, но и барьера, препятствующего прохождению даже мелких молекул между клетками, например из просвета органа к базальной мембране. Они действуют также как барьеры для диффузии белков внутри плазмолеммы, поддерживая в сохранности апикальный и базолатеральный домены.
Десмосомы и адгерентные соединения (зоны сцепления) представляют собой основной тип прикрепительных контактов. Межклеточные адгерентные соединения весьма разнообразны. Во многих неэпителиальных тканях они имеют форму точечных или линейных контактов, связывающих актиновые микрофиламенты в кортикальной цитоплазме смежных клеток. В эпителиальных пластах они часто образуют непрерывный адгерентный пояс около апикального конца каждой из контактирующих клеток. Адгерентный пояс часто называют опоясывающей десмосомой, однако по химическому составу он отличается от настоящих десмосом. Десмо-сомы представляют собой небольшие площадки протяженностью до 0,5 мкм, в которых между плазмолеммами соседних клеток имеется зона с высокой электронной плотностью. В этой зоне к обеим плазмолеммам со стороны цитоплазмы обеих клеток прилегают участки электронно-плотного вещества, так что внутренний слой плазмолемм кажется утолщенным. К таким утолщениям в десмосомах прикреплены промежуточные фила-менты (цитокератины в эпителиях), а в зонах сцепления — мик-рофиламенты актина. Благодаря такой связи между плазмолем-мой и цитоскелетом клеток механическая роль обоих видов межклеточных соединений существенно повышена. При помощи десмосом промежуточные филаменты соседних клеток объединяются в непрерывную сеть, пронизывающую всю ткань. Однако оба этих вида могут нарушаться при патологических состояниях. Так, при пузырчатке (дерматоз с высыпанием пузырей на коже, см. главу 25) в сыворотке крови больных можно обнаружить аутоантитела, направленные против десмосомаль-ных гликопротеинов. Эти антитела связываются с десмосомами и разрушают их, вызывая разъединение эпителиоцитов и образование больших интраэпидермальных пузырей. Полудесмосо-мы морфологически сходны с десмосомами, но отличаются от них функциональными и химическими особенностями. Они скрепляют не плазматические мембраны соседних клеток, а базальную поверхность этих клеток со специализированной структурой внеклеточного матрикса — базальной мембраной (см. ниже).
Щелевидные соединения (нексусы) представляют собой зоны протяженностью 0,5—3 мкм, в которых плазмолеммы разделены промежутком в 2—3 нм. Здесь возможно прохождение мелких молекул от клетки к клетке. Поэтому соседние клетки могут посылать друг другу химические или электрические коммуникационные сигналы.
Многочисленные и разнообразные функции эпителиальных тканей отражаются в их различном строении. Эпителий секреторного типа, например выстилка панкреатического ацинуса, имеет клетки кубической формы, содержит хорошо развитую шероховатую эндоплазматическую сеть и располагается веерообразно, образуя секреторные концевые отделы вставочных протоков. В гистологических срезах секреторные отделы имеют вид обычных железистых трубочек. Иное дело многослойный плоский эпителий. Такая выстилка, как эпидермис, должна постоянно выдерживать механические воздействия. Поэтому, кроме выраженной многослойности, ему присущи обильный набор промежуточных филаментов и многочисленные десмо-сомы.
Базальная мембрана. Эпителиальные клетки вырабатывают компоненты внеклеточного матрикса, которые организуются в сложную пространственную структуру — базальную мембрану, состоящую из сети коллагена IV типа, гликопротеинов ламини-на, фибронектина и энтактина, а также протеогликанов, главным образом гепаран-сульфата (называемого также гепарин-сульфатом). Эпителиальные клетки прикрепляются к базальной мембране посредством полудесмосом, которые, как и десмосо-мы, служат местами фиксации цитоплазматических промежуточных филаментов. Прикрепление клетки к коллагеновой сети, возможно, осуществляется ламинином и фибронектином, которые связываются и с трансмембранными рецепторами клеточной поверхности — интегринами и с коллагеном. При бул-лезном пемфигоиде (см. главу 25) аутоантитела, реагирующие с базальной мембраной многослойного плоского эпителия, имеются в сыворотке крови и, вероятно, участвуют в процессе возникновения субэпидермальных пузырей.
Контакт с базальной мембраной необходим эпителиальным тканям для поддержания всех характеристик и специфичности своего фенотипа, или для поддержания дифференцировки. Кроме того, базальная мембрана всегда служит в качестве своеобразных строительных лесов при восстановлении поврежденного эпителия. По ней клетки могут перемещаться в ходе не только патологической, но и физиологической регенерации. Малигнизированные (озло-качествленные) эпителиоциты (см. главу 7) способны к разрушению базальной мембраны и проникновению за ее пределы, после чего осуществляется их инвазия в окружающие ткани и в кровоток. После циркуляции в кровотоке такие раковые клетки снова должны преодолевать базальную мембрану кровеносных сосудов. В дальнейшем мы увидим, что продукция коллагеназ и других протеолитических ферментов лишь отчасти способствует этому процессу.
2. Соединительная ткань. В отличие от эпителиоцитов клетки соединительной ткани рассеяны. В большей степени это касается волокнистых соединительных (стромальных) тканей, в меньшей — тканей с более специальными свойствами (гладко-мышечной, ретикулярной, жировой, пигментной и др.). Наибольшее значение имеют фибробласты (синтезируют белки и гликозаминогликаны), гладкомышечные клетки (обладают сократительными и иными функциями) и макрофаги (гистиоциты, блуждающие клетки, способные к поглощению и перевариванию поглощенного материала, синтезирующие множество биологически активных веществ). Эти и другие клетки располагаются во внеклеточном матриксе, который может быть плотным (кость) или эластичным (фиброзная ткань). Конечно, и кровь можно отнести к соединительной ткани, в которой внеклеточный матрикс имеет жидкий вид (плазма крови), а клетки необычайно подвижны. Мы еще вернемся к более полному рассмотрению компонентов внеклеточного матрикса в главе 6, а здесь коснемся его лишь в связи с общим обзором по соединительной ткани. Будучи в значительной степени изолированными, клетки соединительной ткани, вместе с тем, способны к межклеточным взаимодействиям. Между такими клетками нередко возникают различные соединения, кроме десмосом. Постоянные сокращения гладкомышечных и сердечных волокон требуют прочного прикрепления соседних волокон (гладкая мускулатура и миокард относятся к мезенхимальным тканям в отличие от скелетных мышц).
 Различные виды соединительной ткани зависят от наличия в ней тех или иных типов клеток — фибробластов, остеобластов, хондроцитов и др., а также от химического состава внеклеточного матрикса, вырабатываемого этими клетками, и от структурной организации компонентов матрикса. Эти компоненты делятся на три категории: элементы, противостоящие линейному натяжению (например, коллаген); молекулы, наполняющие пространство и противостоящие сжатию ткани (например, протео-гликаны); связующие белки (например, фибронектин) (табл. 2.3). Такие отдельные компоненты могут иметь совершенно разное строение. Так, коллагеновые волокна бывают собраны в параллельные пучки (в сухожилиях), в прямоугольные полосы (в роговице) или петлистую сеть (в стекловидном теле глаза).
Различные виды соединительной ткани зависят от наличия в ней тех или иных типов клеток — фибробластов, остеобластов, хондроцитов и др., а также от химического состава внеклеточного матрикса, вырабатываемого этими клетками, и от структурной организации компонентов матрикса. Эти компоненты делятся на три категории: элементы, противостоящие линейному натяжению (например, коллаген); молекулы, наполняющие пространство и противостоящие сжатию ткани (например, протео-гликаны); связующие белки (например, фибронектин) (табл. 2.3). Такие отдельные компоненты могут иметь совершенно разное строение. Так, коллагеновые волокна бывают собраны в параллельные пучки (в сухожилиях), в прямоугольные полосы (в роговице) или петлистую сеть (в стекловидном теле глаза).
Несмотря на то что обновление внеклеточного матрикса происходит медленнее, чем клеток, известно несколько заболеваний, при которых неспособность к расщеплению компонентов внеклеточного матрикса влечет за собой ряд проблем. Например, при остеопетрозе (утолщении кости за счет увеличения слоя компактного вещества) остеокласты не способны к резорбции хрящевого шаблона развивающейся кости. При этом не развиваются пространства для костного мозга, что в итоге приводит к тяжелой анемии. Существует также несколько вариантов нарушенного биосинтеза коллагена, имеющих клиническое выражение. При несовершенном остеогенезе нарушение функции гена коллагена I типа сопровождается патологической ломкостью костей с повторными и множественными переломами (см главу 24). При цинге отсутствие витамина С препятствует гидроксилированию остатков пролина в коллагене, а вслед за этим утрачивается способность коллагеновых волокон к перекрестному связыванию. Кроме того, снижение способности к такому связыванию у коллагена и эластина лежит в основе многих возрастных изменений кожи, точнее ее дермы. Нарушения, касающиеся строения и содержания протеогликанов, обнаружены в хряще при дегенеративных поражениях суставов и при остеоартрите.
3. Молекулы клеточной адгезии. В биологии и патобиологии тканей важную роль играют не только специализированные виды соединений клеток, о которых шла речь, но и непостоянные, подчас скоротечные взаимодействия между клетками, а также между клетками и матриксом. Перечислим ряд важнейших из них: взаимодействия лейкоцитов и тромбоцитов с эндотелием при воспалении, взаимодействия между различными типами клеток при иммунном ответе, адгезия (прикрепление) лейкоцитов к микробам для последующего их фагоцитоза (поглощения), временное прикрепление клеток к матриксу для их передвижения, для восстановительных процессов или для инвазии. Упомянем также о взаимодействии между одинаковыми клетками в таких специализированных тканях, как эпителий, нервная ткань и др.
Существует две главные концепции, объясняющие клеточную адгезию. Физико-химическая концепция предполагает, что силы электростатического отталкивания, действующие между отрицательно заряженными клетками, уравновешиваются электродинамическими силами притяжения, действующими между фосфолипидами плазмолеммы. Все клетки несут на своей поверхности отрицательный электрический заряд, обусловленный карбоксильной группой терминальных остатков сиаловой кислоты на гликопротеинах плазмолеммы. Даже при неспецифической природе этого механизма обеспечиваются количественные различия в адгезии. Если прикрепление сходных клеток друг к другу сильнее, чем у несходных, то смешанная клеточная популяция постепенно рассортируется по территориям, первоначально занятым сходными клетками.
Другая концепция говорит о том, что в процесс клеточной адгезии вовлечены лигандно-рецепторные взаимодействия, определяющие их специфичность и многообразие функций. Молекулы, участвующие в таком процессе, называют молекулами клеточной адгезии (cellular adhesion molecules — CAMs). Однако это название неточное, так как эти молекулы могут содействовать и другим функциям, например трансмембранной сигнальной передаче. Известно несколько групп CAMs (табл. 2.4). Приведенная таблица, разумеется, не полна, поскольку все время описываются новые молекулы и дополнительные функции. Се-лектины — адгезивные молекулы, лектиноподобный домен которых обеспечивает адгезию лейкоцитов к эндотелиальным клеткам. Они играют важную роль в острых воспалительных реакциях и в коагуляции, содействуя адгезии лейкоцитов или тромбоцитов к эндотелию (см. главы 3 и 4). Интегрины — семейство гетеродимерных трансмембранных гликопротеинов, молекулы которых состоят из ковалентно связанных аи р-цепей, формирующих трансмембранные рецепторы. Существует несколько основанных на различиях в их р-цепях подсемейств интегринов. Функция каждого интегрина определяется его единственной в своем роде а-цепью. Рецепторы семейства р, (VLA) были впервые описаны как антигены, появляющиеся на стимулированных лимфоцитах через несколько недель (very late antigen). Они реагируют с белками внеклеточного матрикса и обеспечивают агдезию клеток, выполняя важную роль в передвижении клеток во время эмбриогенеза или при заживлении ран. Семейство р2-интегринов (лейкоцитарные интегрины) участвует в прикреплении лейкоцитов к эндотелиальным клеткам при иммунных процессах (см. главу 4). Экспрессия одного из их лигандов — молекулы межклеточной адгезии-1 (ICAM-1, intercellular adhesion molecule) — перестает быть управляемой при некоторых видах острого и хронического воспаления, развивающихся, например, при вирусных инфекциях, отторжении почечного или печеночного аллотрансплантата (гомотрансплантата, т.е. участка ткани либо целого органа от особи того же вида, взятого для пересадки). Семейства интегринов р3 (цитоадгези-ны) и р4 сходны с группой р, и включают рецепторы к фибриногену, витронектину, тромбосподину и ряду других лигандов. Кадгерины, включающие в себя много семейств, являются кальцийзависимыми молекулами, важными для взаимодействий между сходными клетками в очень многих тканях и организации их цитоскелета. Суперсемейство иммуноглобулинового гена включает рецепторы, которые реагируют с антигенами (например, Т-клеточный рецептор лимфоцитов — TCR), и лиган-ды, реагирующие с лимфоцитарными (ICAM-1, ICAM-2, VCAM-1, см. главу 5) или гомофильными (имеющими такую же структуру) рецепторами соседних клеток.
В ответ на разнообразные стимулы молекулы адгезии претерпевают количественные и качественные изменения. Более того, искусственный синтез сходных молекул или использование специфических моноклональных антител к этим молекулам может иметь клиническое значение при возможности влияния на воспалительное или иммуноопосредованное повреждение тканей
Молекулы адгезии взаимодействуют только с поверхностью, неся на себе соответствующий лиганд. Перед фагоцитом, взаи-
Семейство
Биохимическая природа
Вилы молекул
Функция
Селектины
Интегрины
Кадгерины
Суперсе-| мейство гена иммуноглобулинов
Трансмембранные гликопротеины, углеводные лиганды
Гетеродимеры а/р; разные лиганды, включающие последовательности RGD (аргинин-аспартат-глицин), LDV (лей-цин-аспартат-валин) Кальцийзависимая адгезия
Трансмембранные гликопротеины; кальцийзависимая адгезия; обычно од-нонаправлен ное связывание
Гликопротеины с иммуноглобулино-подобными доменами; кальцийнезави-симая адгезия; гли-копротеин с однонаправленным и разнонаправленным связыванием
Молекула адгезии эндотелия (ELAM-I)
Молекула адгезии лейкоцитов (LAM-1) Белки наружных мембран гранул, зависимые от активации тромбоцитов (PADGEM), или белок-140 мембран гранул (GMP-140)
Семейство Pi: молекулы очень поздней активации (VLA1-6)
Семейство Рг: молекула-1, связанная с функцией лейкоцитов (LFA-1)
МАС-1
р150, 95
Семейство Рз; VNR; гликопротеин тромбоцитов
Семейство Р4
Е-кадгерин N-кадгерин Р-кадгерин
Десмоколлин
N-CAM 1САМ-1
VCAM-1
Прикрепление к эндотелию нейтроф ильных лейкоцитов Расселение лимфоцитов Прикрепление лейкоцитов к эндотелию
Шесть молекул, лиганды которых включают коллаген, фибронектин и ламинин Реагирует с молекулами межклеточной адгезии ICAM-1 и -2 Рецепторы комплемента СЗЫ
Рецептор витро-нектина; фактор прикрепления тромбоцитов Компонент клеточной адгезии в гемидесмосомах
Адгезия эпителиальных, невраль-ных и плацентарных клеток Компонент дес-мосом
Молекула адгезии нервных клеток Лейкоцитарно-эндотел иальное взаимодействие с LFA-1
Лейкоцитарно-эндотелиальное взаимодействие с Р|-интегрином (VLA-4)
модействующим с чужеродными поверхностями, до сих пор не встречавшимися, стоит задача преодолеть эти поверхности путем их покрытия антителом или компонентами комплемента, опсонизации (опсонины — плазменные белки, которые, покрывая какую-либо частицу, облегчают ее фагоцитоз). Кроме того, важным является распознавание некоторых общих качеств у чужеродных поверхностей. Существует соответствие между гидро-фобностью поверхности (неспособность смачиваться или растворяться в воде) какой-либо частицы и той легкостью, с которой эта частица фагоцитируется. В связи с этим отметим, что бактерии, патогенные для человека, имеют обычно весьма гидрофильные поверхности (связывающие воду).
4. Информационный процесс. Межклеточные взаимодействия требуют хорошего информационного обеспечения, при котором должен происходить обмен разнообразными и многочисленными сигналами, а информация должна проходить через плазмо-леммы. Существуют различные механизмы передачи химических сигналов. При классическом эндокринном действии вещество секретируется в кровоток и воздействует на клетки-мишени, удаленные от места секреции. При паракринном сигнальном процессе освобождаются мессенджеры (молекулы-передатчики), которые действуют только в непосредственном окружении продуцирующей клетки на соседние, близко расположенные клетки. Такой способ действия весьма характерен для диффузной эндокринной системы (см. главу 6). Наконец, клетки могут выделять вещества, которые связываются с рецепторами на поверхности самой продуцирующей клетки и изменяют функцию клетки — аутокринная стимуляция. Многие системы (эндокринная, иммунная и центральная нервная) используют не только сходные механизмы для передачи сигналов, но и одни и те же мессенджеры. Поэтому одна и та же молекула может действовать как гормон, нейротрансмиттер или цитокин в зависимости от того, где она подверглась освобождению и для каких клеток-мишеней предназначена.
Механизмы сигнальной трансдукции (перенос информации). Поскольку часть весьма важных сигналов направлена на рост клеток (либо при обновлении, либо при патологических состояниях), то механизмы сигнальной трансдукции мы подробнее рассматриваем в главе 6. Однако множество сигналов служит и другим целям, а потому заслуживает краткого обсуждения. Большинство сигнальных молекул водорастворимо, и немногие из них беспрепятственно пересекают гидрофобный центр плазмолеммы. Поэтому они реагируют с рецепторами на клеточной поверхности. Рецепторами для таких сигнальных молекул являются интегральные (встроенные) мембранные протеины. Таким образом, сама сигнальная молекула часто не проникает в цитоплазму, однако она вызывает формирование вторичных мессенджеров (молекулы-передатчики сигнала внутри цитоплазмы). При реализации сигнальной транс-дукции должны учитываться следующие условия: необходимо, чтобы система обнаружения была достаточно чувствительной и улавливала бы сигнальные молекулы; поскольку концентрация лигандных молекул бывает невелика, то требуется ее увеличение; бывает необходимо объединять функциональные возможности нескольких рецепторов, а для активации разных эффекторов (молекул, обеспечивающих контроль над изменением и синтезом белка, в частности на матричной РНК, т.е. мРНК) использовать объединенный сигнал; если сигнал используется повторно, он должен носить временный характер; чтобы система проводила все разнообразие многочисленных сигналов, нужна ее адаптация к ним.
Сигнальные молекулы пересекают плазмолемму по одному из следующих путей: путем прямого перемещения через нее (так проходят стероидные и тиреоидные гормоны); с помошью изменения ионных каналов (например, в зоне нервно-мышечных соединений); путем связывания сигнальной молекулы со специфическими рецепторами, что вызывает структурные изменения и запуск целого ряда внутриядерных процессов по активации синтеза внутриклеточных белков (см. главу 6).
Передача сигналов через внутриклеточные рецепторы (схема 2.3, квадрат 1). Указанные рецепторы входят в суперсемейство рецепторов клеточного ядра и включают рецепторы стероидных и тиреоидных гормонов, витамина D и ретиноловой кислоты. Они представляют собой полипептиды, состоящие примерно из 800 аминокислот, и имеют три функциональных домена: карбоксильно-терминальный гор-моносвязующий домен; внутренний домен, связывающийся с ДНК; амино-терминальный домен, активирующий или тормозящий транскрипцию генов. Некоторые рецепторы в неактивном состоянии находятся в цитозоле, в то время как другие — в ядре (см. схему 2.3). Предполагается, что, будучи в неактивном состоянии, домен, связывающийся с ДНК, образует комплекс с ингибиторным белком. Связывание с гормоном вызывает отделение рецептора от ингибиторного протеина. В результате этого рецептор приобретает повышенное сродство к определенным последовательностям ДНК, которые начинают работать как эн-хансеры, т.е. стимулировать транскрипцию нескольких соседних генов. Продукты этих генов могут активировать другие гены, усиливая таким образом действие гормона. Один и тот же рецептор в разных клетках-мишенях активирует различные наборы генов, поскольку для транскрипции специфических генов нужны и другие связывающиеся с ДНК белки, которые в разных клетках различны.
Рецепторы, связанные с каналами. Для управления регулируемыми медиаторами ионными каналами, участвующими в основном в быстрой синаптической передаче сигналов между
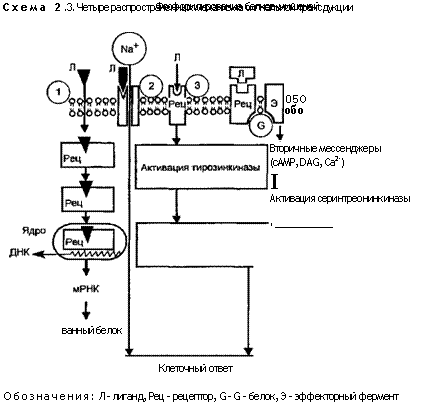 электрически возбудимыми клетками, используются нейроме-диаторы. Связывание с лигандом приводит к открытию или закрытию особого ионного канала (см. схему 2.3, квадрат 2), изменяющего проницаемость плазмолеммы для какого-либо иона, например натрия.
электрически возбудимыми клетками, используются нейроме-диаторы. Связывание с лигандом приводит к открытию или закрытию особого ионного канала (см. схему 2.3, квадрат 2), изменяющего проницаемость плазмолеммы для какого-либо иона, например натрия.
Каталитические рецепторы (катализ — ускорение биохимической реакции в присутствии катализатора, обычно фермента) при активации лигандом начинают работать как ферменты. Большинство известных каталитических рецепторов — трансмембранные белки, цитоплазматический домен которых обладает тирозинкиназной активностью. Активация тирозинкиназы (тирозин — аминокислота, участвующая в синтезе очень многих белков; киназы — ферменты, катализирующие перенос концевой фосфатной группы с АТФ и других нуклеозидтрифосфатов на различные группы других веществ). Обычным механизмом, изменяющим активность белка, является фосфорилирование, т.е. присоединение остатков фосфорных кислот в процессе окисления или синтеза. Существует два типа тирозинкиназ. Один из них фосфорилирует остатки тирозина, другой — остатки серина или треонина (аминокислот, входящих в состав многих белков). Множество каталитических рецепторов являются тирозинкиназами, активированными с помощью лигандов. К ним относятся рецепторы для эпидермального фактора роста (ЭФР) и тромбоцитарного фактора роста (ТцФР). Поэтому ступень, контролируемая тирозинкиназой, очень важна в процессе клеточной пролиферации. Кроме того, несколько производных онкогенов, например erbB, sis (активные клеточные гены, обеспечивающие опухолевую трансформацию клетки), также являются тирозинкиназами. Амплификация (образование дополнительных копий, увеличение количества) сигнальных молекул обусловлена активацией тирозинкиназы (см. схему 2.3, квадрат 3), которая может фосфорилировать множество различных белков, образуя ферментный каскад. Фосфатазы, отщепляющие фосфатные группы от белка и тем самым уменьшающие его активность, обеспечивают временный характер сигнала. Варианты действия фосфатаз плохо изучены, но их большое значение не подвергается сомнению.
Рецепторы, связанные с G-белком, опосредованно активируют или ингибируют определенные ферменты или ионные каналы, связанные с цитоплазматической мембраной посредством гуанозинтрифосфатсвязующего регуляторного G-белка (см. схему 2.3, квадрат 4). Гуанозинтрифосфат (ГТФ) — богатое энергией соединение, участвующее в биосинтезе белка в клетках. Рецепторы, связанные с G-белком, запускают цепь процессов, изменяющих концентрацию одной или нескольких сигнальных молекул — мессенджеров — циклического аденозинмо-нофосфата (цАМФ) и Са2+. Изменение концентрации этих мессенджеров ведет к изменению активности и других клеточных белков. Известно два главных пути передачи сигналов, связанных с G-белком: путь цАМФ и путь Са и фосфатид ил инозито-ла (схема 2.4).
Путь цАМФ. Циклический аденозин монофосфат образуется из АТФ с помощью фермента аденилатциклазы, локализованного в плазмолемме. Повышенные уровни цАМФ приводят к активации цАМФ-зависимой протеинкиназы, которая запускает целый ряд реакций фосфорилирования. Для активации аденилатциклазы необходим мембранный G-белок. Поскольку этот белок участвует в активации фермента, он получил название стимуляторного G-белка (Gs). Подобно всем гетеротример-ным G-белкам он включает в себя три субъединицы: а, р и у. Субъединица а содержит ГТФазу, которая на стадии инактивации гидролизует ГТФ до гуанозиндифосфата (ГДФ). Субъединицы Р и у формируют комплекс, закрепляющий белок на внутренней стороне плазмолеммы. Активация рецептора приводит к замене связи с ГДФ на связь с ГТФ, что вызывает отделение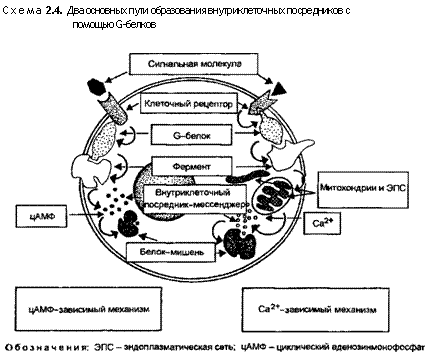
субъединицы а от комплекса Gs. Отделенная от субъединиц р и у а-субъединица связывается с аденилатциклазой, тем самым активируя фермент, в результате чего синтезируется множество молекул цАМФ.
Чтобы быстро реагировать на соответствующие тканевые запросы, уровень активного цАМФ должен обеспечивать быстрые изменения, что достигается с помощью трех механизмов. Во-первых, выработка цАМФ может продолжаться только до тех пор, пока комплексы рецепторов с мессенджерами сохраняются на поверхности клеток. Вместе с тем такие комплексы быстро удаляются при эндоцитозе или нарушениях взаимосвязей. Во-вторых, активированный Gs-белок инактивируется при превращении ГТФ в ГДФ с помощью эндогенной активности ГТФазы в субъединице а. Затем эта субъединица снова объединяется со своими аналогами Р и у для формирования неактивного гетеро-тримера. В-третьих, цАМФ быстро гидролизуется под воздействием фосфодиэстераз.
Например, при холере энтеротоксин возбудителя Vibrio cho-lerae, предотвращая гидролиз ГТФ, обеспечивает устойчивую активацию белка Gs в эпителиальных клетках кишечника. Высокий уровень цАМФ становится причиной избыточного выделения воды и электролитов в просвет кишки, объясняющего наличие некупируемой диареи.
Некоторые рецепторно-лигандные взаимодействия тормозят активность аденилатциклазы посредством ингибиторного G-белка (G;), у которого отличается субъединица а (а;), но субъединицы Р и у имеют то же строение, что и у белка Gs. Один из токсинов возбудителя коклюша Bordetella pertussis, вызывающий приступы судорожного кашля, модифицирует а-субъеди-ницу Gj-белка, препятствуя его взаимодействию с рецепторами. В результате при активации рецептора активность его не инги-бируется. Повышение уровня цАМФ подавляет иммунный ответ, способствуя тем самым выживаемости возбудителя. Кроме того, одновременно создаются возможности для развития вторичных инфекций, вызывающих серьезные осложнения у больных детей.
Помимо аденилатциклазы, некоторые G-белки могут активировать фосфолипазу С и связывать активацию рецептора с изменением концентрации Са2+.
Путь кальция и фосфатидилинозитола. Концентрация свободных ионов внутриклеточного Са2+ очень низка, тогда как концентрации Са2+ во внеклеточном пространстве и в специальном внутриклеточном накопительном компартменте достаточно высока. Большая часть внутриклеточного кальция находится в неионной форме и изолирована в различных органеллах или объединена в фосфат кальция или же связана кальцийсвязую-щими белками. В связи с этим образующийся высокий градиент Са2+ стремится «проталкивать» их в цитозоль через плазматическую мембрану и мембраны накопительных органелл. Чрезвычайно высокая концентрация Са2+ во всей толще плазмолем-мы поддерживается энергией, получаемой в результате гидролиза АТФ, чтобы нагнетать эти ионы против градиента как из клеток, так и в органеллы. Открытие Са2+-каналов под действием какого-либо сигнала приводит к потоку Са2+ в цитозоль, локальному повышению их концентрации и активации чувствительных к ним механизмов. Подобный механизм характерен для электрически чувствительных нервных клеток. Деполяризация плазматической мембраны в момент прихода потенциала действия вызывает открытие потенциалзависимых Са2+-каналов, поглощение Са2+ нервным окончанием и инициирует секрецию нейромедиатора.
Другой механизм передачи сигналов Са2+ характерен для всех эукариотических клеток. Связывание сигнальной молекулы с клеточным рецептором ведет к освобождению Са2+ из внутриклеточных хранилищ. Открытие Са2+-каналов во внутриклеточных мембранах связано с действием инозитол-1,4,5-три-фосфата (1Р3). Он образуется в плазмолемме в результате быстрого гидролиза инозитолфосфолипидов. Наиболее важную роль в передаче сигнала играют два фосфорилированных произ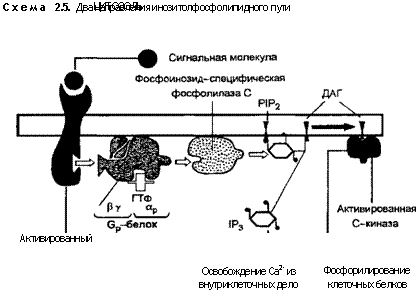 Обозначения: ГТФ-гуанианозинтрифосфат, 1Р3-инозитолтрифосфат, ДАГ-диацилглицерол, Р1Р2 фосфатидилбифосфат
Обозначения: ГТФ-гуанианозинтрифосфат, 1Р3-инозитолтрифосфат, ДАГ-диацилглицерол, Р1Р2 фосфатидилбифосфат
водных фосфатидилинозитола (РІ) — РІ-фосфат (PIP) и Р1-би-фосфат (Р1Р2).
Присоединение сигнальной молекулы к плазмолемме активирует G-белок (Gp), который в свою очередь активирует фос-фолипазу С, а последняя превращает РІР2 в два вторичных мес-сенджера — [Р3 и диацилглицерол (ДАГ). Здесь пути передачи сигнала разделяются на два направления (схема 2.5).
1Р3 повышает уровень внутриклеточного Са2+ путем стимуляции его освобождения из резервов эндоплазматической сети. Подобно цАМФ уровень цитозольного кальция может быстро изменяться. Быстрое поступление внеклеточного Са2+ или освобождение его из внутриклеточных резервов уравновешиваются продуктивным нагнетанием (накачиванием) кальция из цитозоля в органеллы или во внеклеточную жидкость. Са2+ активирует многочисленные внутриклеточные ферменты путем прямого или непрямого связывания и активации кальцийсвязующего белка кальмоду-лина. Одной из важнейших функций кальмодулина является активация кальмодулинзависимой протеинкиназы.
ДАГ может распадаться дальше с образованием арахидоно-вой кислоты, необходимой для синтеза простагландинов и других медиаторов липидной природы (см. главу 4), или активировать кальцийзависимую протеинкиназу С, которая затем фос-форилирует особые белки на остатках серина и треонина, контролирующие внутриклеточный рН. Повышение рН в клетке способствует ее пролиферации. Очевидно поэтому форболовые эфиры (форболэстеры), действующие как аналоги ДАГ, вызывают постоянную активацию протеинкиназы С, стимулируя клеточный рост, чем и объясняется их мощное содействие в развитии опухолей.
5. Цитокины. Среди биологически активных молекул, регулирующих межклеточные взаимодействия, важные для поддержания постоянной структуры тканей, одно из ведущих мест занимают цитокины. Подобно нейротрансмиттерам и гормонам, они образуют специальный класс сигнальных молекул. Это простые низкомолекулярные пептиды или гликопротеины, продуцируемые практически всеми типами клеток, но главным образом — макрофагами и лимфоцитами. Синтез цитокинов регулируется на уровне транскрипции и трансляции. Сами они оказывают короткодистанционное действие по типу аутои пара-кринного механизма, связываясь со специфическими клеточными рецепторами, но некоторые цитокины обладают эндокринным эффектом.
В зависимости от направленности этого действия выделяют 6 групп цитокинов (табл. 2.5), из которых наиболее изучены ин-терлейкины и факторы роста. Подробнее о функциях и роли этих и других цитокинов речь пойдет в других главах. Здесь же мы ограничимся общей характеристикой некоторых интерлей-кинов (ИЛ) и факторов роста (ФР).
В ответ на инфекцию, действие микробных токсинов, агентов воспаления, продуктов активированных лимфоцитов и комплемента в тканях и плазме крови обнаруживается высокий уровень ИЛ-1 (эндогенный пироген) в двух его полипептидных вариантах ИЛ-1а и ИЛ-1Р. Связывание ИЛ-1 с соответствующими рецепторами на Т-лимфоцитах и макрофагах сопровождается рядом проявлений пирогенного эффекта: повышением температуры тела, головной болью, нарушением сна и др. Подобные эффекты связаны с действием ИЛ-1 на термосенсорные центры в переднем гипоталамусе и стимуляцией образования простагландина (ПГ)Е2Сходное действие оказывает и другой цитокин — фактор некроза опухоли (ФНО). Оба его варианта: ФНОа и ФНОр, — помимо пирогенного эффекта и активации клеток воспалительного ответа, способны in vitro уничтожать опухолевые клетки. Отсюда и возникло название фактора. Ряд других цитокинов, например колониестимулирующие факторы (КСФ), оказывают стимулирующее влияние на клетки-предшественники в костном мозге. Стимулируя пролиферацию этих клеток, они способствуют развитию нейтрофильного лейкоцитоза и лимфоцитоза (увеличение в крови количества соответствующих клеток) при разных формах воспаления.
Группа
Направленность деисгвии
Виды
Цитокины, опосредующие естественный иммунитет
Вызывают неспецифический | ИЛ-1, ИЛ-6, иммунный ответ. Обеспечи-1ИЛ-8, ФНОа, вают защиту против вирус| интерфероны ной инфекции
Цитокины, регулирующие рост, активацию и диффе-ренцировку лимфоцитов
Цитокины, активирующие клетки воспалительного инфильтрата
Цитокины, стимулирующие гемопоэз
Цитокины, регулирующие рост резидентных клеток
Цитокины, связанные с внеклеточным матриксом Мембраносвязанные циСпособствуют росту и диф-ференцировке лимфоцитов
Активируют клетки воспалительного инфильтрата
Стимулируют рост и образование новых клеток крови, воздействуя на клетки-предшественники
Стимулируют или тормозят рост и дифференцировку резидентных клеток
Стимулируют ангиогенез
ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-12, ТФРр
Интерферон-?, ФНОа, ФНОр, ИЛ-8
Колониестиму-лирующие факторы
ЭФР, оФРФ, кФРФ, ТцФР, ИПФР-1, ИПФР-2, ТФРа, ИЛ-1, ФНОа
оФРФ, ТФРВ
Примечание. ИЛ — интерлейкин, ФИО — фактор некроза опухоли, ТФР — трансформирующий фактор роста, ЭФР — эпидермальный фактор роста, ФРФ — фактор роста фибробластов; о — основной; к — кислый, ТцФР — фактор роста тромбоцитов, ИПФР — инсулиноподобный фактор роста
Спектр биологического действия факторов роста не менее, а подчас и более широк, чем у интерлейкинов (см. табл. 2.5). Они могут стимулировать и тормозить рост клеток (пролиферация), хемотаксис (передвижение клеток, основанное на разнице в концентрации ионов или какого-либо вещества на клеточных рецепторах и в микроокружении) и даже дифференцировку (приобретение специализированного фенотипа) клеток. Большинство факторов роста действует по паракринному или ауто-кринному типу. Некоторые из них, например инсулиноподобный фактор роста (ИПФР), имеют эндокринный механизм или способны оказывать интракринное действие. В этом случае факторы роста никуда не выделяются и не нуждаются в рецепторах на плазмолемме. Они остаются внутри клеток-продуцентов и действуют как внутриклеточные мессенджеры, регулируя функции клеток. К таким веществам относятся тромбоцитарный фактор роста (ТцФР), основной и кислый факторы роста фибробластов (кФРФ и оФРФ). Внутриклеточные факторы роста устойчивы к разрушению и могут непосредственно влиять на генетический аппарат клетки.
Эпидермальный фактор роста (ЭФР), обладая эндо-, параи эндокринными функциями и будучи обнаруженным в крови, ликворе, слюне, желудочном соке и др., играет важную роль в канцерогенезе (см. главу 7). В плазмолемме клеток большинства эпителиальных тканей сильно развиты рецепторы (ЭФР-Р) к этому полипептиду. Недавно выяснилось, что естественным ли-гандом для этого рецептора является пептид, тесно связанный с ЭФР и названный трансформирующим фактором роста а (ТФРа). Экспрессия ТФРа существенно увеличивается при развитии новообразований на фоне уменьшения экспрессии ЭФР. Помимо ТФРа, существует ТФРр, свойства которого существенно отличаются от ТФРа. В наибольшем количестве они синтезируются тромбоцитами и моноцитами при различных повреждениях и, кроме своих стимулирующих свойств (например, ТФРр индуцирует образование внеклеточного матрикса при заживлении), обладают также трансформирующим действием на клетки (см. главу 7).
Функции большинства цитокинов и ростовых факторов достаточно разнообразны и во многом зависят от клеточного микроокружения.
Обсуждение Патологическая анатомия
Комментарии, рецензии и отзывы
